ΤΑ ΤΕΛΟΜΕΡΗ ΚΑΙ Η ΤΕΛΟΜΕΡΑΣΗ
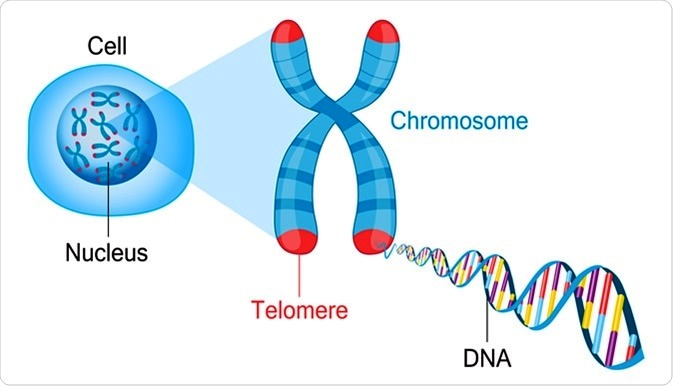
Τα τελομερή είναι ειδικοί προστατευτικοί σχηματισμοί που “σφραγίζουν” τις δυο άκρες των χρωματοσωμάτων για να προστατεύσουν το DNA από τη φθορά, που συμβαίνει τόσο κατά τις κυτταρικές διαιρέσεις όσο και σε άλλες περιπτώσεις που δημιουργείται βλάβη στο DNA (π.χ. σε φάσεις οξειδωτικού stress).
Τα τελομερή εμποδίζουν τα χρωματοσώματα από συνένωση μεταξύ τους και επίσης θυσιάζονται – καταστρέφονται αυτά αντί για τα χρήσιμα γονίδια κατά τον αυτοδιπλασιασμό του DNA (στη φάση της σύνθεσης), πριν τη φάση της μίτωσης στις κυτταρικές διαιρέσεις.
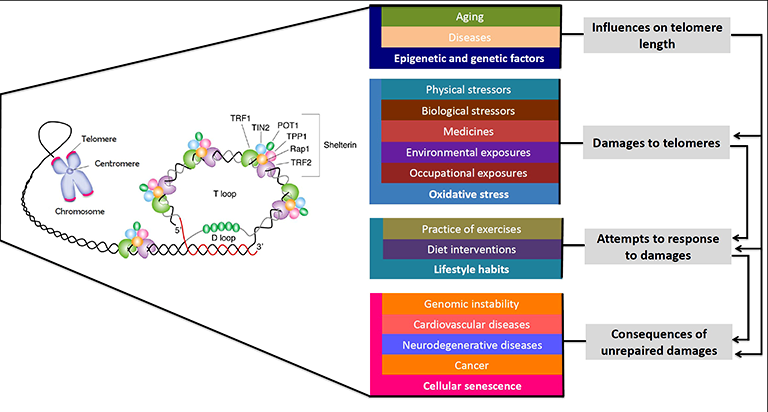
Η μείωση του μήκους των τελομερών σχετίζεται με τη γήρανση του οργανισμού και τις παθήσεις που τη συνοδεύουν (δεν γνωρίζουμε αν την προκαλούν ή αν και τα δυο οφείλονται σε άλλο παράγοντα που προκαλεί και τα δύο).
Η μακροβιότητα μας και το μήκος των τελομερών μας, εξαρτώνται από τα γονίδια μας, από τον τρόπο ζωής μας, την αισιοδοξία ή απαισιοδοξία μας, το περιβάλλον που ζούμε και τα καλά ή κακά που συμβαίνουν στη ζωή μας.
Δεν έχουν όλοι οι άνθρωποι ίδιο μήκος τελομερών γιατί το μήκος τους καθορίζεται εν μέρει κληρονομικά και εν μέρει επιγενετικά (από εξωγενείς αιτίες όπως το οξειδωτικό stress).
Επιγενετικά το μήκος τους μικραίνει από: Την υπεριώδη ηλιακή ακτινοβολία και από άλλα είδη ακτινοβολίας, από ορισμένες τοξίνες, από ορισμένες χημικές αρωματικές ουσίες όπως το βενζόλιο και το τολουένιο, από ιώσεις, από φλεγμονές, από κακή διατροφή, από κάπνισμα, από τη ρύπανση της ατμόσφαιρας, από πολύ αλκοόλ (όσο περισσότερο το αλκοόλ τόσο μικρότερο το μήκος των τελομερών) κλπ.
Επιπλέον επιγενετικά το μήκος των τελομερών μειώνεται και από το μακροχρόνιο άγχος (συνεχώς αυξημένη κορτιζόνη) τόσο στην ενήλικη ζωή όσο και στην παιδική ηλικία και από παχυσαρκία (λόγω παραγωγής φλεγμονωδών λιποκυτοκινών).
Μεγαλύτερο μήκος τελομερών έχουν οι γυναίκες (λόγω των οιστρογόνων), όσοι ασκούνται, όσοι χάσουν σωματικό βάρος, όσοι δεν έχουν ψυχολογικό stress, όσοι ακολουθούν τη μεσογειακή διατροφή κλπ.
Επίσης όποιος αντιμετωπίζει τη ζωή με αισιοδοξία (και με καλούς φίλους) παρουσιάζει λιγότερη μείωση των τελομερών του (Elizabeth Blackburn, βραβείο Nobel).
Επιπλέον αν ο πατέρας είναι μεγάλης ηλικίας κατά τη σύλληψη του απογόνου, λόγω του ότι τα τελομερή των σπερματικών κυττάρων μεγαλώνουν αντί να μικραίνουν με την ηλικία (λόγω ύπαρξης τελομεράσης), τα παιδιά του θα έχουν μεγαλύτερα τελομερή.
Επίσης ο ρυθμός μείωσης του μήκους των τελομερών διαφέρει από χρωματόσωμα σε χρωματόσωμα και από ιστό σε ιστό.
ΤΑ ΤΕΛΟΜΕΡΗ ΚΑΙ Η ΑΤΕΛΗΣ ΑΝΤΙΓΡΑΦΗ ΤΩΝ 2 ΑΚΡΩΝ ΤΟΥ ΧΡΩΜΑΤΟΣΩΜΑΤΟΣ
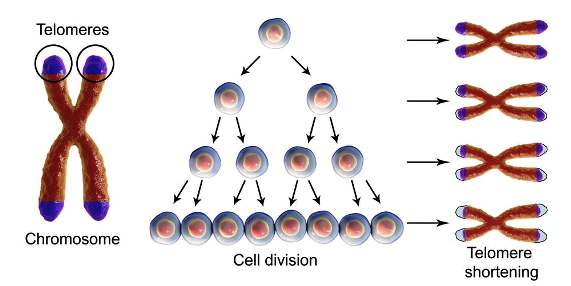
Τα νουκλεοτίδια-βάσεις των τελομερών δεν έχουν πληροφορίες για κατασκευή πρωτεϊνών και (όπως αναφέρθηκε πιο πάνω) σε κάθε διπλασιασμό του DNA (άρα σε κάθε κυτταρική διαίρεση), καταστρέφονται αυτές, αντί για το υπόλοιπο DNA που είναι χρήσιμο για την παραγωγή πρωτεϊνών (coding DNA).
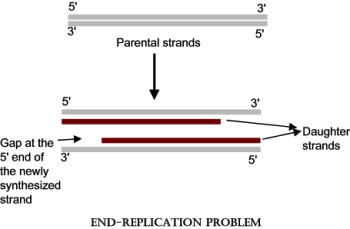
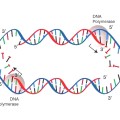
Αυτό χρειάστηκε να γίνει, γιατί υπάρχει μια κατασκευαστική ατέλεια στην αντιγραφή του DNA (end replication problem).
Συγκεκριμένα ένα κομμάτι του τελομερούς, στην 5’ άκρη της lagging strand, χάνεται σε κάθε αναδιπλασιασμό του DNA, κάθε φορά που το κύτταρο πρόκειται να διαιρεθεί.
Οπότε οι ακολουθίες TTAGGG του τελομερούς στο τέλος 3’ της leading strandτου DNA μένουν- προεξέχουν μόνες τους, χωρίς συμπληρωματικές βάσεις απέναντι.
Η αδυναμία πλήρους σύνθεσης της lagging strand του DNA, αναφέρεται σαν “5′ end replication problem”.
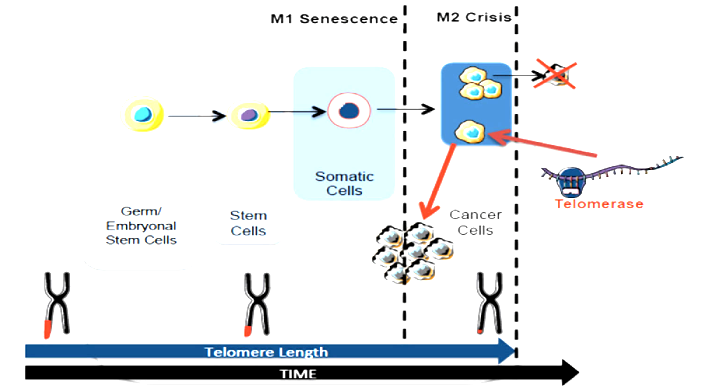
Έτσι το μήκος των τελομερών κάθε κυττάρου μειώνεται σταδιακά σε κάθε κυτταρική διαίρεση. Το ανώτερο όριο των κυτταρικών διαιρέσεων λέγεται Hayflick Limit και στα περισσότερα κύτταρα είναι οι 40-70 φορές.
ΤΑ ΤΕΛΟΜΕΡΗ, Ο ΚΥΤΤΑΡΙΚΟΣ ΚΥΚΛΟΣ ΚΑΙ Η ΓΗΡΑΝΣΗ ΤΟΥ ΟΡΓΑΝΙΣΜΟΥ
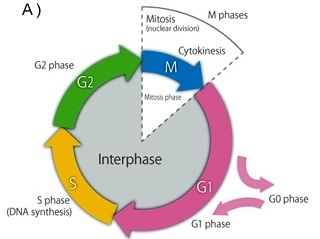
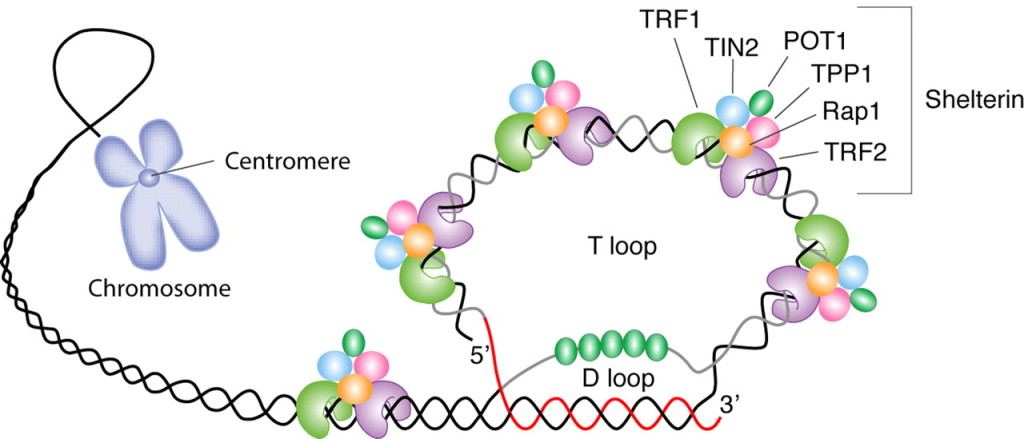
Όταν τα τελομερή φτάσουν σε ένα οριακά μικρό μήκος ή/και αν οι πρωτεΐνες που το προστατεύουν (shelterin complex) παρουσιάσουν δυσλειτουργία, το DNA ενεργοποιεί το μηχανισμό της απάντησης σε βλάβη του DNA (DNA damage response ή DDR), οπότε το κύτταρο εγκαταλείπει τη φάση G1 του κυτταρικού κύκλου και μπαίνει στη φάση G0, αρχικά προσωρινά.
Αν το κύτταρο δεν καταφέρει να επιδιορθώσει το DNA του, τότε η παραμονή του στη φάση G0 γίνεται μη αναστρέψιμη, μπαίνει σε “γήρανση“ από πλευράς διαιρέσεων (φάση Replication Senescence).
Όσα κύτταρα είναι σ’ αυτή τη φάση, δεν μπορούν να ξαναμπούν στον κυτταρικό κύκλο και στο τέλος καταλήγουν σε θάνατο.
Η replicative Senescence είναι η ανικανότητα του κυττάρου να ξαναδιαιρεθεί ενώ η γήρανση του κυττάρου είναι η μη αποδοτική λειτουργία του λόγω συσσώρευσης βλαβών με την πάροδο του χρόνου.
Τα κύτταρα διαφόρων ηλικιών μπορούν να παρουσιάσουν replicative Senescence και ίσως αυτή να είναι και μηχανισμός προστασίας του οργανισμού για εξάλειψη (μέσω του ανοσοποιητικού συστήματος) όσων κυττάρων έχουν παρουσιάσει βλάβη στο DNA τους.
Υπ’ όψιν ότι εν μέρει η γήρανση του οργανισμού και η έναρξη παθήσεων που σχετίζονται με το γήρας οφείλεται και στη μείωση του μήκους των τελομερών των ενήλικων βλαστοκυττάρων, γιατί μειώνεται η ικανότητα τους να αυτοδιπλασιάζονται και συνεπώς και η ικανότητα τους να επιδιορθώνουν όσα σωματικά κύτταρα δεν μπορούν να αυτοδιπλασιαστούν.
Η replicative senescence των σωματικών κυττάρων που διαιρούνται και των ενήλικων βλαστοκυττάρων, που αντέχουν περισσότερους κύκλους διαίρεσης, προκαλούν μαζί με άλλους επιγενετικούς παράγοντες, τελικά τη γήρανση του οργανισμού.
Αυτό γίνεται όταν τα κύτταρα με replicative senescence αυξάνονται σε αριθμό- συσσωρεύονται ή/και αν το γερασμένο ανοσοποιητικό δεν μπορεί να τα καταστρέψει.
Όσο μεγαλύτερο το μήκος των τελομερών, τόσο πιο πολλές κυτταρικές διαιρέσεις μπορούν να γίνουν, με αποτέλεσμα τη μείωση των εκφυλιστικών παθήσεων (της αθηρωμάτωσης συμπεριλαμβανομένης), αλλά δυστυχώς την αύξηση ορισμένων μορφών καρκίνου (λόγω αύξησης των μεταλλάξεων από τους περισσότερους διπλασιασμούς του DNA).
Το μήκος των τελομερών μπορεί να μετρηθεί ακριβέστερα με τη μέθοδο TeSLA (Telomere Shortest Length Assay).
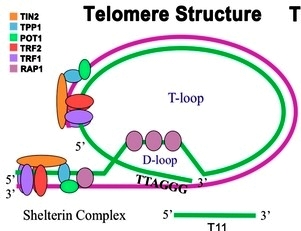
Η ΚΑΤΑΣΚΕΥΗ ΤΟΥ ΤΕΛΟΜΕΡΟΥΣ ΚΑΙ ΤΟ ΤΕΛΙΚΟ ΤΜΗΜΑ ΤΟΥ – Η T LOOP
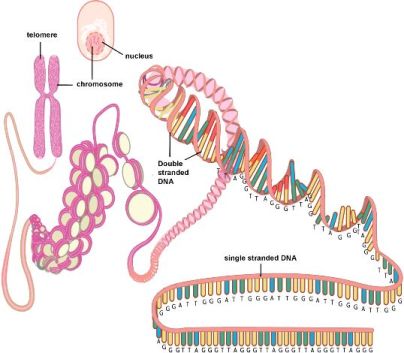
Τα νουκλεοτίδια- βάσεις στα τελομερή είναι εκατοντάδες (σε μεγαλύτερη ηλικία) και περίπου 2.5 χιλιάδες (σε μικρότερη ηλικία) επαναλαμβανόμενες ακολουθίες των 6 νουκλεοτιδίων-βάσεων ΤΤΑGGG, στο τέλος, στην πλευρά 3’, της κύριας θυγατρικής έλικας του DNA (leading strand).
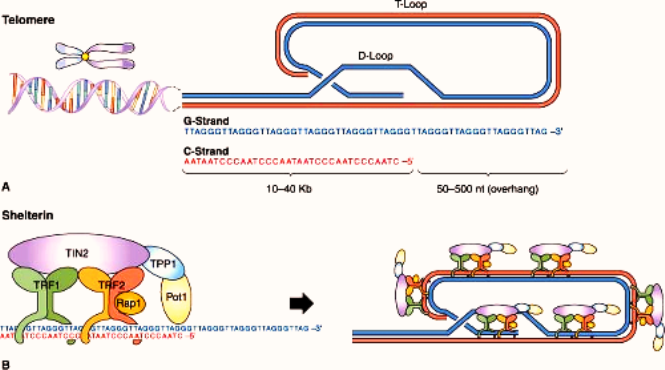
Όμως το τελείως τελικό τμήμα (3’) της leading strand του DNA με δεκάδες (5-70) επαναλαμβανόμενες εξάδες βάσεων TTAGGG παραμένει μόνο του (G-strand overhang), χωρίς συμπληρωματική- δευτερεύουσα έλικα.
Αυτό γίνεται λόγω της εγγενούς αδυναμίας της ολοκλήρωσης του τελικού κομματιού (5’) της θυγατρικής δευτερεύουσας έλικας του DNA (lagging strand), οπότε δεν κατασκευάζονται οι αντίστοιχες- συμπληρωματικές δεκάδες εξάδες βάσεων, ΑΑΤCCC (end replication problem).
Το τελείως τελικό τμήμα του τελομερούς προστατεύεται με το σχηματισμό μιας “θηλιάς” που λέγεται T-loop (και μιας μικρότερης, της D loop) και επίσης από ειδικό σύμπλεγμα 6 πρωτεϊνών, που λέγονται Shelterin complex και προστατεύουν το τελομερές από το να θεωρηθεί ότι είναι DNA με βλάβη, που χρειάζεται επισκευή.
Η T-loop αποτελείται από τη μονή κύρια έλικα (με τις επαναληπτικές ακολουθίες των 6 βάσεων TTAGGG) που διπλώνεται προς τα πίσω και διεισδύει τελικά στη διπλή έλικα του τελομερούς ενωνόμενη μαζί της. Η T-loop σταθεροποιείται με τις 6 πρωτεΐνες Shelterin complex.
Η ΤΕΛΟΜΕΡΑΣΗ
Το ανώτερο όριο των κυτταρικών διαιρέσεων ( Hayflick Limit) δεν ισχύει για όλα τα κύτταρα.
Μερικά ενήλικα κύτταρα δημιουργώντας τελομεράση, μπορούν να διαιρούνται πολύ περισσότερες φορές, όπως τα ενήλικα βλαστοκύτταρα (stem cells) και οι απόγονοι τους, τα progenitor cells. Το ίδιο συμβαίνει δυστυχώς και στα κύτταρα του 85-90% των καρκίνων.
Η τελομεράση υπάρχει άφθονη στα εμβρυικά βλαστοκύτταρα (embryonic stem cells) μέχρι τον 3ο μήνα περίπου και επίσης στα σπερματικά κύτταρα του άντρα.
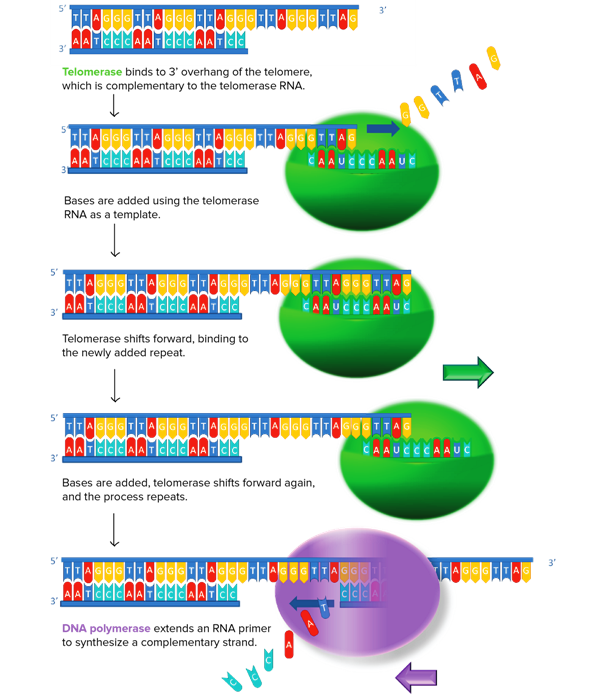
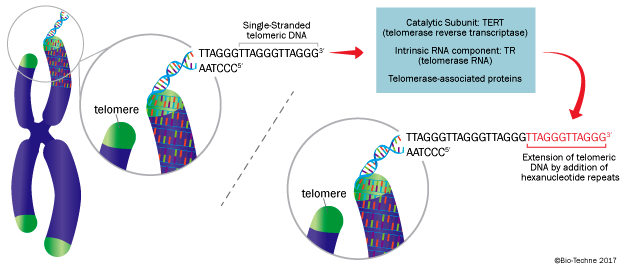
Η τελομεράση αυξάνει το μήκος των τελομερών (με τη βοήθεια και της DNA πολυμεράσης) και έτσι αυξάνεται ο αριθμός των κυτταρικών διαιρέσεων.
Όμως όσο αυξάνονται οι κυτταρικές διαιρέσεις αυξάνεται και ο κίνδυνος να προκληθεί καρκίνος, από αυξημένες πιθανότητες μετάλλαξης.
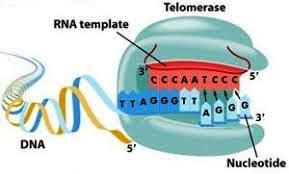
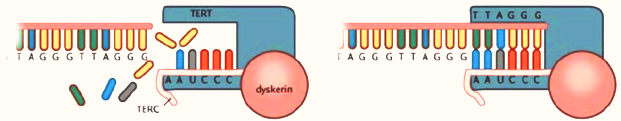
Η τελομεράση είναι μια Ριβονουκλεοπρωτεΐνη που αποτελείται από το ένζυμο – υπομονάδα TERT, το “καλούπι” – υπομονάδα TERC και βοηθητικές πρωτεΐνες.
α) Η TERT (TElomerase Reverse Transcriptase) προσθέτει επαναλαμβανόμενα τις 6 βάσεις TTAGGG στην 3’ άκρη της leading strand του τελομερούς, για να την επεκτείνει.
Σαν “καλούπι” χρησιμοποιείται η υπομονάδα TERC (TElomerase RΝΑ Component) που έχει τις επαναληπτικές βάσεις ΑΑUCCC.
Στα ανθρώπινα ενήλικα κύτταρα η TERC υπάρχει μόνιμα, ενώ το γονίδιο που “παράγει” την TERT είναι αδρανοποιημένο, εκτός από τα ενήλικα βλαστοκύτταρα, τα progenitor cells, τα σπερματικά κύτταρα του άντρα και τα κύτταρα του 85-90% των καρκίνων.
β) Μετά η DNA πολυμεράση προσθέτει τις βάσεις ΑΑΤCCC απέναντι από την άκρη της leading strand, ώστε να ξαναδημιουργηθεί η διπλή έλικα του τελομερούς.
ΣΥΜΠΕΡΑΣΜΑΤΙΚΑ: Δεν καπνίζουμε, τρώμε υγιεινά, βαδίζουμε πολύ, δεν είμαστε υπέρβαροι, βλέπουμε τη ζωή με αισιοδοξία σαν μισογεμάτο και όχι μισοάδειο ποτήρι, γελούμε, τραγουδούμε, χορεύουμε, δεν γκρινιάζουμε, έτσι ώστε τα τελομερή μας να μικραίνουν με βραδύτερο ρυθμό.
ΕΝΔΕΙΚΤΙΚΗ ΒΙΒΛΙΟΓΡΑΦΙΑ
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6560729/
https://www.mdpi.com/2073-4409/8/1/30/
htmhttp://jcb.rupress.org/content/216/4/875