ΚΑΡΚΙΝΟΣ ΘΕΡΑΠΕΙΑ – ΦΑΡΜΑΚΑ
Ενημερώθηκε στις 8/1/2023
Οι καθιερωμένες θεραπείες του καρκίνου μέχρι πριν λίγα χρόνια ήταν τέσσερις, η χειρουργική, η ακτινοθεραπεία, η χημειοθεραπεία και η ορμονοθεραπεία.
Όμως εδώ και λίγα χρόνια συντελείται μια πραγματική επανάσταση στη θεραπεία του καρκίνου, με την ανοσοθεραπεία και τη στοχευμένη θεραπεία και τελευταία χρησιμοποιούνται και επιγενετικά φάρμακα.
Πολλές φορές χρησιμοποιούνται συνδυασμοί των διαφόρων θεραπειών διαδοχικά ή και ταυτόχρονα.
# Τα αντικαρκινικά φάρμακα αλφαβητικά, φαίνονται στην ιστοσελίδα του Αμερικανικού Ινστιτούτου Καρκίνου (NCI):
https://www.cancer.gov/about-cancer/treatment/drugs
# Τα αντικαρκινικά φάρμακα που δρουν σε διάφορους τύπους καρκίνου φαίνονται στην ιστοσελίδα του Αμερικανικού Ινστιτούτου Καρκίνου (NCI):
https://www.cancer.gov/about-cancer/treatment/drugs/cancer-type
>> Άρθρο για τον Τροφοβλαστικό καρκίνο της κύησης (Χοριοκαρκίνωμα) μπορείτε να δείτε: Εδώ
Η ΧΕΙΡΟΥΡΓΙΚΗ ΘΕΡΑΠΕΙΑ χρησιμοποιείται σε στέρεους όγκους που δεν έχουν μεταστάσεις και επιπλέον εντοπίζονται σε προσβάσιμα σημεία του σώματος. Μόνη της όμως, συνοδεύεται από αυξημένη πιθανότητα υποτροπής.
Η ΑΚΤΙΝΟΘΕΡΑΠΕΙΑ
Η ακτινοθεραπεία σκοτώνει ή σταματά τις διαιρέσεις στα καρκινικά κύτταρα προκαλώντας μεγάλη βλάβη στο DNA τους.
Η ακτινοθεραπεία, αναλόγως της περίπτωσης, μπορεί να χρησιμοποιηθεί μόνη της ή συμπληρωματικά με άλλες αντικαρκινικές θεραπείες.
Η ακτινοθεραπεία μπορεί να γίνει με εξωτερική πηγή ακτινοβολίας ή με χορήγηση- τοποθέτηση εσωτερικής πηγής ακτινοβολίας.
Η ΧΗΜΕΙΟΘΕΡΑΠΕΙΑ
Η χημειοθεραπεία δυστυχώς σκοτώνει γενικά όλα τα κύτταρα που διαιρούνται γρήγορα (κυτταροτοξική), έτσι σκοτώνει τόσο τα καρκινικά όσο και τα υγιή κύτταρα που διαιρούνται συχνά.
Τα υγιή κύτταρα που επηρεάζονται περισσότερο από τη χημειοθεραπεία είναι αυτά που βρίσκονται στο μυελό των οστών, συνεπώς μπορεί να υπάρξουν λοιμώξεις από μείωση των λευκών αιμοσφαιρίων (δυστυχώς οι περισσότερες λοιμώξεις οφείλονται στους μικροοργανισμούς που υπάρχουν ήδη στο γαστρεντερικό σύστημα και στο δέρμα), αιμορραγίες από μείωση των αιμοπεταλίων και αναιμία από μείωση των ερυθρών αιμοσφαιρίων.
Επίσης επηρεάζονται τα κύτταρα του βλεννογόνου του γαστρεντερικού συστήματος οπότε συχνά εμφανίζονται ξηροστομία ή πληγές στο στόμα, δυσκολία στην κατάποση, ναυτία- εμετός, διάρροια ή δυσκοιλιότητα, επιπλέον επηρεάζονται τα κύτταρα των θυλάκων των τριχών οπότε εμφανίζεται τριχόπτωση κλπ.
Λόγω των πιο πάνω κυτταροτοξικών δράσεων της χημειοθεραπείας παρουσιάζεται γενική εξάντληση.
Έτσι εξ’ αιτίας των αναπόφευκτων παρενεργειών της χημειοθεραπείας, αυτή πρέπει να χρησιμοποιείται μόνο όπου αναμένεται μεγαλύτερο όφελος συγκριτικά με τη ζημιά.
Οι πιο ευαίσθητοι καρκίνοι στη χημειοθεραπεία είναι ο καρκίνος των όρχεων, ορισμένα λεμφώματα, ο καρκίνος του τραχήλου της μήτρας, ο καρκίνος των ωοθηκών, το Χοριοκαρκίνωμα [τροφοβλαστική νεοπλασία της κύησης (gestational trophoblastic neoplasia ή GTN)] κλπ.
Η ΟΡΜΟΝΟΘΕΡΑΠΕΙΑ χρησιμοποιείται κυρίως για ορισμένους ορμονοευαίσθητους καρκίνους του προστάτη και του μαστού και δρα στερώντας τους την ορμόνη που χρειάζονται τα καρκινικά κύτταρα για να πολλαπλασιαστούν.
Μερικά από τα φάρμακα εμποδίζουν τις ορμόνες να δρουν στα κύτταρα, συμπεριλαμβανομένων και των καρκινικών κυττάρων, ενώ άλλα εμποδίζουν την παραγωγή των ορμονών.
Η ΑΝΟΣΟΘΕΡΑΠΕΙΑ
Λόγω του ότι η χημειοθεραπεία σκοτώνει και τα υγιή κύτταρα, μεταξύ αυτών και κύτταρα του ανοσοποιητικού συστήματος, τα τελευταία χρόνια χρησιμοποιείται η ανοσοθεραπεία.
Η ανοσοθεραπεία (βιολογική θεραπεία) ενισχύει το ανοσοποιητικό σύστημα του ασθενούς ώστε να εντοπίζει και να σκοτώνει αυτό τα καρκινικά κύτταρα.
Γι’ αυτό είναι καλύτερα να χρησιμοποιείται νωρίς μετά τη διάγνωση του καρκίνου, που ακόμη το ανοσοποιητικό είναι ισχυρό.
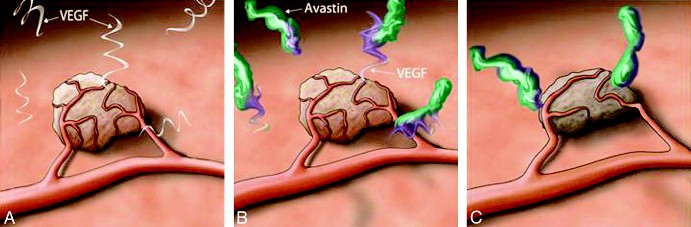
[Τελευταία χρησιμοποιούνται για τους συμπαγείς καρκίνους : Immune checkpoint inhibitors (ανοσοθεραπεία) για εντονότερη δράση των Τ λεμφοκυττάρων στην εξόντωση των καρκινικών κυττάρων π.χ. η Atezolizumab-Tecentriq) + θεραπευτικά μονοκλωνικά αντισώματα (στοχευμένη θεραπεία) που αναστέλλουν τη δημιουργία νέων αγγείων π.χ. η Bevacizumab–Avastin.
https://ascopubs.org/doi/full/10.1200/EDBK_237987]
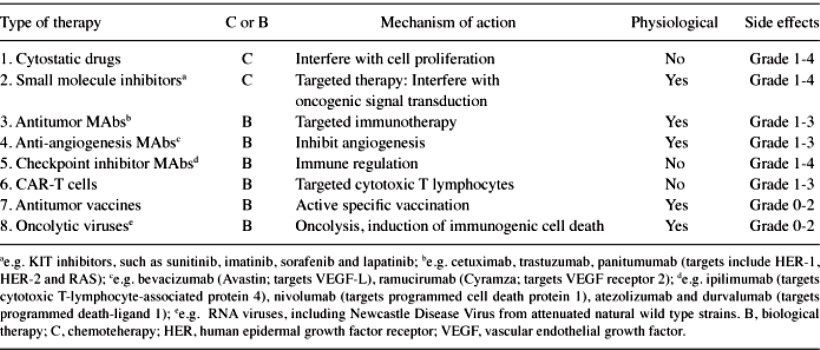
ΟΙ ΣΤΟΧΕΥΜΕΝΕΣ ΘΕΡΑΠΕΙΕΣ
Επειδή δεν υπάρχει καρκίνος που να είναι ακριβώς ο ίδιος σε διαφορετικούς ανθρώπους, άρχισε να εφαρμόζεται η θεραπεία ακριβείας (precision medicine) και η στοχευμένη θεραπεία (targeted therapy), που ελπίζουμε να θεραπεύει τον καρκίνο κάθε ανθρώπου, ανάλογα με την αιτιολογία του (τα γονίδια που ευθύνονται για τη δημιουργία του).
Η στοχευμένη θεραπεία είναι το θεμέλιο της θεραπεία ακριβείας (precision medicine) και στοχεύει τις αλλαγές στα καρκινικά κύτταρα.
Οι στοχευμένες θεραπείες δρουν με διάφορους τρόπους σε πρωτεΐνες (μοριακούς στόχους) στα καρκινικά κύτταρα.
Οι στόχοι αυτοί ανιχνεύονται, μετά από βιοψία, με εξακρίβωση των υπεύθυνων γονιδίων (και των πρωτεϊνών τους) που δημιουργούν τα καρκινικά κύτταρα σε κάθε άνθρωπο.
ΤΑ ΕΠΙΓΕΝΕΤΙΚΑ ΦΑΡΜΑΚΑ
Τα επιγενετικά φάρμακα δρουν στα επιγενετικά ένζυμα και κατατάσσονται βάσει της δράσης τους σ’ αυτά.
Δυστυχώς όμως οι δράσεις τους δεν είναι ειδικές, δηλαδή πέρα από τη επαναλειτουργία των tumor suppressor genes που είχαν “σιωπήσει” παθολογικά, μπορεί να επαναλειτουργήσουν και τα γονίδια που προκαλούν καρκίνο.
ΚΑΡΚΙΝΟΣ ΚΑΙ ΚΑΡΔΙΑ
Με τη διάγνωση του καρκίνου, μέρα από τη φυσική εξέταση και το ΗΚΓφημα, σε όσους προϋπάρχει Καρδιακή Πάθηση και σε όσους θα χορηγηθούν Καρδιοτοξικά φάρμακα, θα ελεγχθούν:
α) Τα καρδιακά ένζυμα, Τροπονίνη και Νατριουρητικά Πεπτίδια (φυσιολογικές τιμές: cTnI/T < 99η εκατοστιαία θέση, BNP < 35 pg/mL, NT-proBNP < 125 pg/mL)
β) Η συστολική λειτουργία της καρδιάς, με υπερηχοκαρδιογραφικό έλεγχο δηλαδή το κλάσμα εξωθήσεως της αριστερής κοιλίας ιδανικά με τρισδιάστατο υπερηχογραφικό έλεγχο, και το GLS, που δεν πρέπει να μεταβληθεί πάνω από 15%).
(GLS =Global Longitudinal Strain = Σφαιρική επιμήκης μεταβολή του μυοκαρδίου της αριστερής κοιλίας)
> Αν ο υπερηχοκαρδιογραφικός έλεγχος δεν είναι διαγνωστικός, θα διενεργηθεί Καρδιακή Μαγνητική Τομογραφία.
Η πιθανή Καρδιοτοξική βλάβη από τα φάρμακα εξαρτάται από το είδος του αντικαρκινικού φαρμάκου και από την κατάσταση της καρδιάς του ανθρώπου που διαγνώστηκε με καρκίνο.
> Η Καρδιοτοξική βλάβη μπορεί να υπολογιστεί από τον πίνακα 4 των οδηγιών της Ευρωπαϊκής Καρδιολογικής Εταιρίας.
https://academic.oup.com/eurheartj/article/43/41/4229/6673995
>> Αν ο κίνδυνος από μια αντικαρκινική θεραπεία εκτιμηθεί σαν υψηλός/πολύ υψηλός θα χορηγηθούν προληπτικά: ACE-I (ή Σαρτάνες) + β αναστολείς και Στατίνες σε όσους θα λάβουν φάρμακα που μπορεί να προκαλέσουν Καρδιακή Ανεπάρκεια – τοξικότητα (π.χ. Anthracyclines και/ή Anti-HER2)
## Οι πιθανές βλάβες στην καρδιά και τα αγγεία από την αντικαρκινική θεραπεία, παρουσιάζονται στα πιο κάτω άρθρα:
https://academic.oup.com/eurheartj/article/43/41/4229/6673995
https://academic.oup.com/eurheartj/article/37/36/2768/2197413
https://www.sciencedirect.com/science/article/pii/S0735109717409971
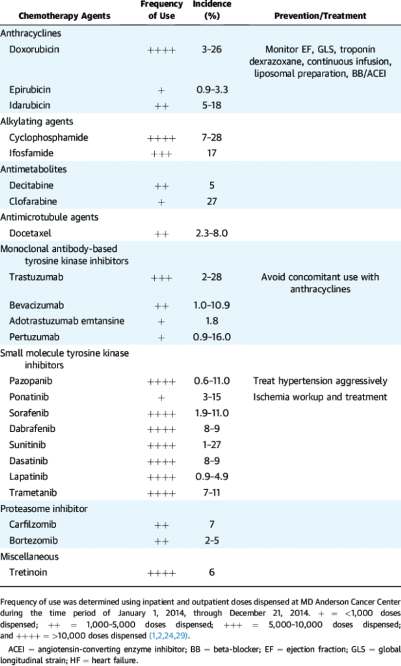
Στον πιο πάνω πίνακα φαίνονται τα αντικαρκινικά φάρμακα που μειώνουν τη σύσπαση της καρδιάς (το κλάσμα εξωθήσεως).
Η ΑΝΤΙΚΑΡΚΙΝΙΚΗ ΘΕΡΑΠΕΙΑ ΜΕ ΠΕΡΙΣΣΟΤΕΡΕΣ ΛΕΠΤΟΜΕΡΕΙΕΣ
Η ΑΚΤΙΝΟΘΕΡΑΠΕΙΑ
Η ακτινοθεραπεία σκοτώνει ή σταματά τις διαιρέσεις στα καρκινικά κύτταρα προκαλώντας μεγάλη βλάβη στο DNA τους.
Η ακτινοθεραπεία, αναλόγως της περίπτωσης, μπορεί να χρησιμοποιηθεί μόνη της ή συμπληρωματικά με άλλες αντικαρκινικές θεραπείες.
Η ακτινοθεραπεία μπορεί να γίνει με εξωτερική πηγή ακτινοβολίας ή με χορήγηση- τοποθέτηση εσωτερικής πηγής ακτινοβολίας.
α) Η ακτινοθεραπεία με εξωτερική πηγή, από ειδικό μηχάνημα, μπορεί να γίνει με δέσμη σωματιδίων φωτονίων (που προκαλεί βλάβη κατά την πορεία της και στους υγιείς ιστούς πριν και μετά τον όγκο) ή με δέσμη σωματιδίων πρωτονίων που προκαλεί βλάβη μόνο στον όγκο. (Η δέσμη ηλεκτρονίων δρα μόνο επιφανειακά)
Η ακτινοθεραπεία με δέσμη-ες εξωτερικής πηγής ακτινοβολίας χρησιμοποιεί εικόνες από ιατρικές διαγνωστικές συσκευές όπως η αξονική τομογραφία, η μαγνητική τομογραφία και το ΡΕΤ (Positron Emission Tomography) για να συγκεντρωθεί στον όγκο (με τη βοήθεια προγράμματος υπολογιστή).
Αυτή είναι διαφόρων ειδών:
# 3-D conformal radiation therapy. Σ’ αυτήν δέσμες μικροσωματιδίων από διάφορες κατευθύνσεις χορηγούνται- στοχεύουν τον όγκο, έτσι υπάρχει ελάχιστη μόνο βλάβη στους υγιείς ιστούς.
Μια μορφή της 3-D conformal radiation therapy είναι η Intensity-modulated radiation therapy (IMRT) που χρησιμοποιεί πολύ περισσότερες και μικρότερες δέσμες μικροσωματιδίων, ρυθμιζόμενης έντασης.
Μια μορφή της IMRT είναι η Image-guided radiation therapy (IGRT) που χρησιμοποιεί εικόνες από ιατρικές διαγνωστικές συσκευές κατά τη διάρκεια της ακτινοθεραπείας, ώστε προσαρμόζεται καλύτερα η ακτινοθεραπεία στον όγκο.
Άλλη μορφή της IMRT είναι η Τομοθεραπεία (Tomotherapy) που χρησιμοποιεί αξονική τομογραφία για καθοδήγηση της δέσμης της ακτινοβολίας.
# Όταν η ακτινοθεραπεία με δέσμη-ες εξωτερικής πηγής ακτινοβολίας χρησιμοποιείται για μικρούς όγκους με ξεκάθαρα όρια, στο Κεντρικό Νευρικό Σύστημα (π.χ. Εγκέφαλο), αντί για εγχείρηση, ονομάζεται Στερεοτακτική ραδιοεγχείρηση (Stereotactic radiosurgery). Μια μορφή της είναι το GammaKnife.
β) Η ακτινοθεραπεία με εσωτερική πηγή ακτινοβολίας, με ραδιενεργό υλικό, μπορεί να γίνει είτε με συμπαγή πηγή (π.χ. καψούλες με ραδιενεργό υλικό) και λέγεται βραχυθεραπεία είτε με ραδιο-ισότοπα, σε υγρή μορφή μέσω του αίματος και λέγεται συστηματική ακτινοθεραπεία.
Η συστηματική ακτινοθεραπεία μπορεί να γίνει είτε με ραδιενεργό Ιώδιο 131 π.χ. σε ορισμένους καρκίνους του θυρεοειδή είτε με ραδιο-ισότοπα σε μικροσφαίρες (π.χ. για καρκίνο του ήπατος) είτε με στοχευμένη ραδιο-ισοτοπική θεραπεία που χρησιμοποιεί ραδιο-ισότοπα ενωμένα με μονοκλωνικά αντισώματα που συνδέονται με αντιγόνα και υποδοχείς που υπάρχουν μόνο στην επιφάνεια των καρκινικών κυττάρων (ραδιο-ανοσοθεραπεία).
Η ραδιο-ανοσοθεραπεία (Radioimmunotherapy ή RIT) χρησιμοποιείται, προς το παρόν, κυρίως για μερικούς αιματολογικούς καρκίνους και ιδίως για κατηγορίες λεμφώματος- ΝΗL).
Λόγω υπερβολικού κόστους μόνο το σκεύασμα Zevalin υπάρχει στην αγορά. Αυτό αποτελείται από το μονοκλωνικό αντίσωμα ibritumomab και ραδιενεργό Ύτριο 90 που εκπέμπει β- ακτινοβολία.
Στο μέλλον ίσως χρησιμοποιείται ραδιενεργός Μόλυβδος 212 (212Pb) που εκπέμπει α- ακτινοβολία. Αυτή είναι πιο αποτελεσματική και ταυτόχρονα λιγότερο βλαβερή για τα υγιή κύτταρα.
Η ΑΝΟΣΟΘΕΡΑΠΕΙΑ (ΒΙΟΛΟΓΙΚΗ ΘΕΡΑΠΕΙΑ)
Λόγω του ότι η χημειοθεραπεία σκοτώνει και τα υγιή κύτταρα, μεταξύ αυτών και κύτταρα του ανοσοποιητικού συστήματος, τα τελευταία χρόνια χρησιμοποιείται η ανοσοθεραπεία.
Η ανοσοθεραπεία (βιολογική θεραπεία) ενισχύει το ανοσοποιητικό σύστημα του ασθενούς ώστε να εντοπίζει και να σκοτώνει αυτό τα καρκινικά κύτταρα.
Γι’ αυτό είναι καλύτερα να χρησιμοποιείται νωρίς μετά τη διάγνωση του καρκίνου, που ακόμη το ανοσοποιητικό είναι ισχυρό.
Αυτή είναι πιο φυσιολογική θεραπεία γιατί δεν σκοτώνει φυσιολογικά κύτταρα (ιδίως αυτά που διαιρούνται συχνά), όπως κάνει η χημειοθεραπεία.
Έτσι η ανοσοθεραπεία έχει λιγότερες παρενέργειες από άλλες θεραπείες και από αυτήν, τις λιγότερες παρενέργειες έχουν τα θεραπευτικά αντικαρκινικά εμβόλια και η θεραπεία με τους ιούς.
https://www.spandidos-publications.com/ijo/54/2/407
Η ανοσοθεραπεία περιλαμβάνει διάφορα είδη θεραπειών:
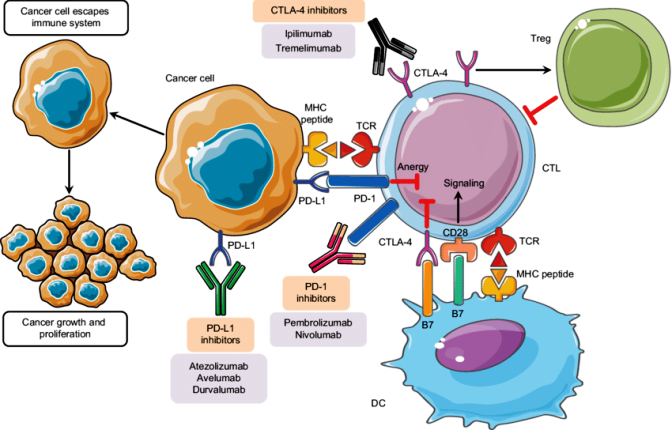
i) Οι Immune checkpoint inhibitors είναι φάρμακα (μονοκλωνικά αντισώματα) που αναστέλλουν τη δράση των πρωτεϊνών (checkpoint proteins) που εμποδίζουν το ανοσοποιητικό σύστημα από το να δρα υπέρμετρα εναντίον των φυσιολογικών κυττάρων του σώματος, ώστε να μην προκαλούνται αυτοάνοσες παθήσεις.
Με τους Immune checkpoint inhibitors το ανοσοποιητικό σύστημα αντιδρά εντονότερα και τα Τ λεμφοκύτταρα του, αρχίζουν να εξοντώνουν τα καρκινικά κύτταρα (που είχαν ενεργοποιήσει τις checkpoint proteins για να αποφύγουν τη θανάτωση).
Οι checkpoint inhibitors ωφελούν περισσότερο αν χορηγηθούν νωρίς και ιδίως σε συνδυασμό με άλλες θεραπείες, συμπεριλαμβανομένων και άλλων ανοσοθεραπειών.
Μερικοί από τους εγκεκριμένους Immune checkpoint inhibitors δρουν εναντίον των checkpoint πρωτεϊνών CTLA-4 (η Ipilimumab–Yervoy) και PD-1 (η Pembrolizumab–Keytruda, για το μελάνωμα, καρκίνο πνεύμονα, στομάχου, λέμφωμα Hodgkin κλπ., η Nivolumab–Opdivo, για καρκίνους πνεύμονα, δέρματος, ουροδόχου κύστης, λέμφωμα Hodgkin κλπ. και εναντίον της partner πρωτεΐνης PD-L1 (η Atezolizumab–Tecentriq, η Avelumab– Bavencio).
[Επίσης η Durvalumab– Imfinzi για ορισμένους τύπους καρκίνου της ουροδόχου κύστεως.]
https://www.cancer.gov/about-cancer/treatment/types/immunotherapy/checkpoint-inhibitors
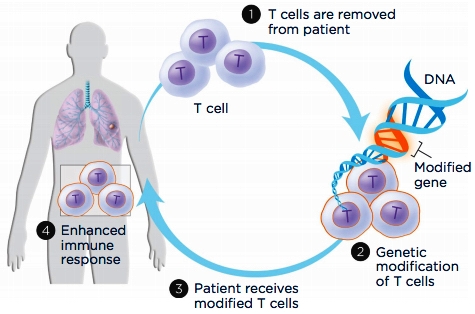
ii) Θεραπεία με επαναχορήγηση Τ – Λεμφοκυττάρων (T–cell transfer therapy)
Σ’ αυτήν αφαιρούνται και επαναχορηγούνται Τ λεμφοκύτταρα του ασθενούς αφού πολλαπλασιαστούν στο εργαστήριο, ώστε να εξοντώσουν ευκολότερα τα καρκινικά κύτταρα.
Η θεραπεία είναι δυο ειδών η TIL (Tumor Infiltrating Lymphocytes) και η CAR T-cell therapy (CAR = Chimeric Antigen Receptor).
Στην TIL πολλαπλασιάζονται εργαστηριακά τα Τ λεμφοκύτταρα που βρίσκονται στον όγκο και επαναχορηγούνται.
Στην CAR T-cell therapy πολλαπλασιάζονται αφού τροποποιηθούν στο εργαστήριο.
[Τα CAR –T λεμφοκύτταρα (Chimeric Antigen Receptor -T cells) αποτελούν ένα συνθετικό ανοσοποιητικό σύστημα που σχεδιάστηκε για να σκοτώνει καρκινικά κύτταρα.
Αφαιρούνται λεμφοκύτταρα του ασθενούς και επεξεργάζονται στο εργαστήριο. Τα CAR –T λεμφοκύτταρα δημιουργούνται με γενετική μηχανική ώστε να έχουν έναν τεχνητό υποδοχέα (chimeric antigen receptor) που θα στοχεύει σε συγκεκριμένο αντιγόνο – πρωτεΐνη του καρκινικού κυττάρου.
Τα CAR -T λεμφοκύτταρα στη συνέχεια εισάγονται στον ίδιο ασθενή, όπου πολλαπλασιάζονται σε εκατομμύρια και επιτίθενται και σκοτώνουν τα καρκινικά κύτταρα. Αφού σκοτώσουν τα καρκινικά κύτταρα παραμένουν στο σώμα, πιθανώς εφ’ όρου ζωής, και αν ξαναδημιουργηθούν καρκινικά κύτταρα, τα εξοντώνουν άμεσα.
Εξ’ αιτίας της διαδικασίας αυτής εκλύονται τεράστιες ποσότητες Ιντερλευκίνης 6 (IL-6) που γίνονται επικίνδυνες για τη ζωή. Αυτές δημιουργούν ένα σύνδρομο με υψηλό πυρετό και βλάβη οργάνων (πιθανώς και κώμα) που ονομάζεται Cytokine Release Syndrome ή CRS.
Έτσι όταν δημιουργηθεί το CRS, χορηγείται και το μονοκλωνικό αντίσωμα Tocilizumab (RoActemra) που σταματά τη δράση της IL-6 και τα βλαβερά αποτελέσματα της.
(Το φάρμακο Tocilizumab χρησιμοποιείται σε Ρευματοειδή Αρθρίτιδα και σε Νεανική Ιδιοπαθή Αρθρίτιδα)]
Έχουν εγκριθεί δυο φάρμακα του τύπου CAR T-cell therapy για αιματολογικούς καρκίνους, το Tisagenlecleucel (Kymriah) και το Axicabtagene ciloleucel (Yescarta).
https://www.cancer.gov/about-cancer/treatment/types/immunotherapy/t-cell-transfer-therapy
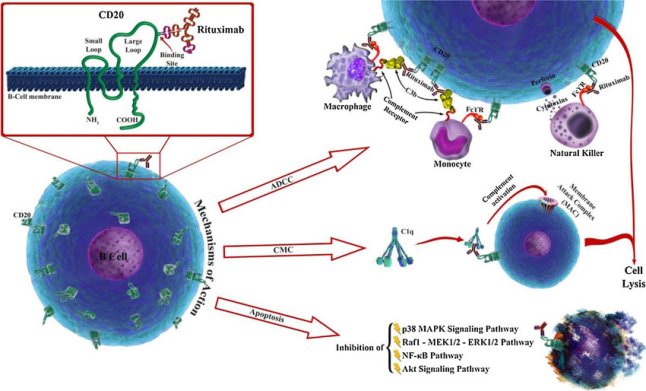
iii) Τα Ανοσοθεραπευτικά Μονοκλωνικά αντισώματα που “μαρκάρουν” τα καρκινικά κύτταρα ώστε να τα εξοντώσουν τα κύτταρα του ανοσοποιητικού συστήματος.
Παραδείγματα αυτών είναι η Rituximab-Mabthera, κυρίως για αιματολογικούς καρκίνους (π.χ. NHL) και η Blinatumomab–Blincyto, κυρίως για Λευχαιμίες.
https://www.cancer.gov/about-cancer/treatment/types/immunotherapy/monoclonal-antibodies
Το μονοκλωνικό αντίσωμα Mosunetuzumab ενώνεται με τα Τ κύτταρα (αμυντικά κύτταρα) και ταυτόχρονα τα καρκινικά Β κύτταρα σε ανθεκτικό Non–Hodgkin Λέμφωμα οπότε αυτά καταστρέφονται (με επιτυχία 50% στους 9 μήνες).
Συνέδριο Αμερικανικής Αιματολογικής Εταιρίας (ASH, Orlando 6 Δεκεμβρίου 2019)
https://ash.confex.com/ash/2019/webprogram/Paper123742.html
iv) Τα θεραπευτικά αντικαρκινικά εμβόλια (Cancer treatment vaccines) βοηθούν το ανοσοποιητικό σύστημα (Τ λεμφοκύτταρα) να αναγνωρίζει τα αντιγόνα των καρκινικών κυττάρων (tumor-associated antigens) ώστε να εξοντώνει ευκολότερα τα καρκινικά κύτταρα.
Τα αντιγόνα των καρκινικών κυττάρων (ή νεοαντιγόνα) είναι οι ελαττωματικές πρωτεΐνες που εκφράζουν (παράγουν) τα μεταλλαγμένα γονίδια των καρκινικών κυττάρων.
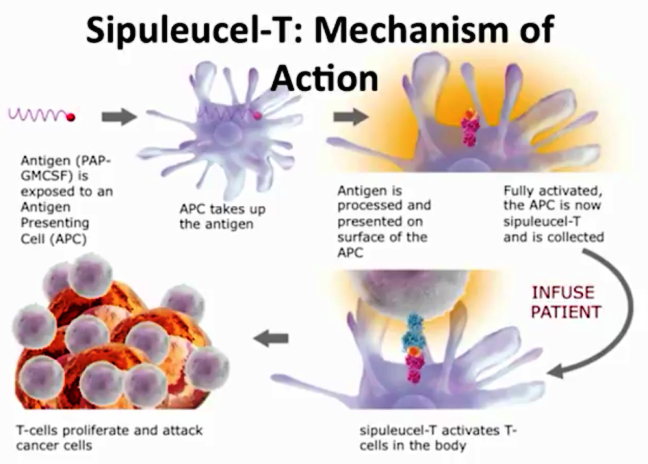
Τα θεραπευτικά αντικαρκινικά εμβόλια δημιουργούνται είτε από τα καρκινικά κύτταρα του ιδίου του ασθενούς είτε από γνωστά αντιγόνα ειδικών καρκίνων είτε χρησιμοποιώντας ειδικά κύτταρα του ανοσοποιητικού (δενδριτικά κύτταρα– dendritic cells) και χρησιμοποιούνται κυρίως για καρκίνο του νεφρού και για μελάνωμα.
Ένα τέτοιο εμβόλιο είναι το dendritic sipuleucel-T (Provenge) που χρησιμοποιείται για μη ορμονοεξαρτώμενο καρκίνο του προστάτη.
https://www.cancer.gov/about-cancer/treatment/types/immunotherapy/cancer-treatment-vaccines
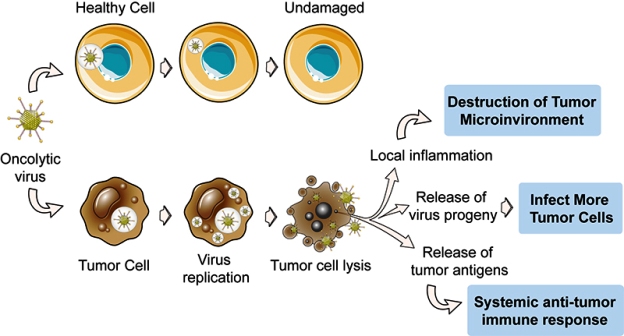
v) Θεραπεία με ιούς (OVs) που καταστρέφουν τα καρκινικά κύτταρα (oncolytic virus therapy) άμεσα ή/και έμμεσα με τη βοήθεια του ανοσοποιητικού συστήματος.
Οι ιοί αυτοί είναι διαφόρων ομάδων (π.χ. Herpes simplex virus- HSV) και καταστρέφουν μόνο τα καρκινικά κύτταρα. Συχνά χρειάζεται να τροποποιηθεί γενετικά ο ιός πριν να χορηγηθεί για να έχει επιτυχία.
Η πρώτη oncolytic virus therapy που εγκρίθηκε από το FDA είναι το talimogene laherparepvec (T-VEC ή Imlygic) που βασίζεται στον ιό του απλού έρπητα. Αυτό χορηγείται μέσα στον όγκο και χρησιμοποιείται σε ορισμένους ασθενείς με μελάνωμα.
Λόγω του ότι μετά την καταστροφή των καρκινικών κυττάρων ελευθερώνονται καρκινικά αντιγόνα, ταυτόχρονα δραστηριοποιείται και το ανοσοποιητικό σύστημα που αρχίζει και αυτό να εξοντώνει καρκινικά κύτταρα, γι’ αυτό και η oncolytic virus therapy μπορεί να θεωρηθεί και σαν τύπος θεραπευτικού αντικαρκινικού εμβολίου.
Συχνά συνδυάζεται αυτή η θεραπεία με τους Immune checkpoint inhibitors (δες πιο πάνω), για καλύτερα αποτελέσματα.
Δοκιμάζεται η oncolytic virus therapy και σε άλλους καρκίνους και επιπλέον με ενδοφλέβια χορήγηση.
https://www.cancer.gov/news-events/cancer-currents-blog/2018/oncolytic-viruses-to-treat-cancer
vi) Τροποποιητές – Διεγέρτες του ανοσοποιητικού συστήματος (Immune system modulators).
Αυτοί ενισχύουν τη δράση του ανοσοποιητικού απέναντι στα καρκινικά κύτταρα και περιλαμβάνουν κυρίως τρεις κατηγορίες παραγόντων:
α)τις Κυτοκίνες
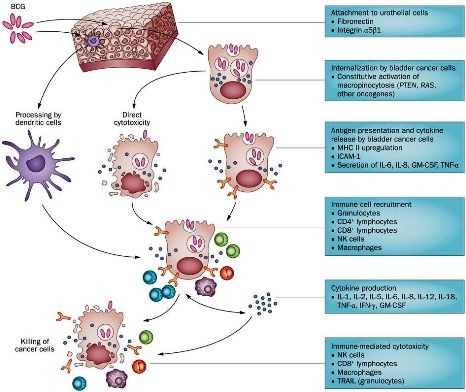
β) το εμβόλιο BCG (αντιφυματικό εμβόλιο) χρησιμοποιείται για τη θεραπεία του καρκίνου της κύστης.
γ) μερικά ανοσο-διεγερτικά φάρμακα (ή biological response modifiers). Αυτά προκαλούν διέγερση της Ιντερλευκίνης 2 και επίσης σταματούν τον καρκίνο από το να δημιουργήσει νέα αγγεία για να μεγαλώσει.
Αυτά είναι η Θαλιδομίδη, που χρησιμοποιείται μαζί με άλλο-α αντικαρκινικά φάρμακα μόλις διαγνωστεί πολλαπλούν μυέλωμα, η Lenalidomide–Revlimid, που χρησιμοποιείται για το πολλαπλούν μυέλωμα και το μυελοδυσπλαστικό σύνδρομο, επίσης μαζί με το αντίσωμα Rituximab, κυρίως για μερικούς τύπους λεμφωμάτων και η Pomalidomide–Pomalyst, που χρησιμοποιείται κυρίως για το πολλαπλούν μυέλωμα.
https://www.cancer.gov/about-cancer/treatment/types/immunotherapy/immune-system-modulators
ΟΙ ΣΤΟΧΕΥΜΕΝΕΣ ΘΕΡΑΠΕΙΕΣ
Επειδή δεν υπάρχει καρκίνος που να είναι ακριβώς ο ίδιος σε διαφορετικούς ανθρώπους, άρχισε να εφαρμόζεται η θεραπεία ακριβείας (precision medicine) και η στοχευμένη θεραπεία (targeted therapy), που ελπίζουμε να θεραπεύει τον καρκίνο κάθε ανθρώπου, ανάλογα με την αιτιολογία του (τα γονίδια που ευθύνονται για τη δημιουργία του).
Η στοχευμένη θεραπεία είναι το θεμέλιο της θεραπεία ακριβείας (precision medicine) και στοχεύει τις αλλαγές στα καρκινικά κύτταρα.
Οι στοχευμένες θεραπείες δρουν με διάφορους τρόπους σε πρωτεΐνες (μοριακούς στόχους) στα καρκινικά κύτταρα.
Οι στόχοι αυτοί ανιχνεύονται, μετά από βιοψία, με εξακρίβωση των υπεύθυνων μεταλλαγμένων γονιδίων (και των πρωτεϊνών τους) που δημιουργούν τα καρκινικά κύτταρα σε κάθε άνθρωπο.
Μερικές στοχευμένες θεραπείες μεταφέρουν θανατηφόρες τοξίνες ή χημειοθεραπευτικά φάρμακα ή ουσίες με ακτινοβολία ώστε να σκοτώσουν τα καρκινικά κύτταρα, άλλες σταματούν τις διαιρέσεις τους (εμποδίζοντας τη λειτουργία των πρωτεϊνών που προκαλούν τις κυτταρικές διαιρέσεις), άλλες προκαλούν το θάνατο τους, άλλες σημαδεύουν τα καρκινικά κύτταρα ώστε να τα εξοντώσει το ανοσοποιητικό σύστημα, άλλες καταστέλλουν την αγγειογένεση, ώστε να συρρικνωθεί ο όγκος κλπ.
https://www.mycancergenome.org/content/page/overview-of-targeted-therapies-for-cancer/
https://chemocare.com/chemotherapy/what-is-chemotherapy/targeted-therapy.aspx
Οι στοχευμένες θεραπείες είναι κυρίως:
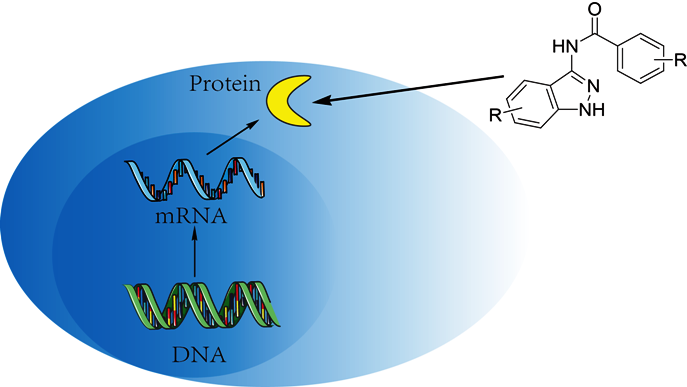
α) Μικρομοριακά φάρμακα για αναστολή της ενζυματικής δραστηριότητας των πρωτεϊνών στόχων (π.χ. της πρωτεϊνικής τυροσινικής κινάσης) μέσα στα καρκινικά κύτταρα (ονομάζονται small molecule inhibitors ή SMIs και συνήθως έχουν κατάληξη σε -ib).
β) Θεραπευτικά μονοκλωνικά αντισώματα (έχουν κατάληξη σε mab) που στοχεύουν ειδικά αντιγόνα στην εξωτερική επιφάνεια του καρκινικού κυττάρου (π.χ. παράγοντες ανάπτυξης όπως ο EGFR ή διαμεμβρανικούς υποδοχείς).
Μερικές δε φορές τα μονοκλωνικά αντισώματα μπορεί να μεταφέρουν κυτταροτοξικές ουσίες (π.χ. Brentuximab-vedotin, με εμπορικό όνομα Adcetris, Trastuzumab-emtansine με εμπορικό όνομα Kadcyla) ή να μεταφέρουν ραδιοϊσότοπα (π.χ. Ibritumomab με ραδιενεργό Ύτριο 90, με εμπορικό όνομα Zevalin). https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6413273/
α) Μικρομοριακά φάρμακα
# Μερικοί small molecule inhibitors είναι αναστολείς της πρωτεϊνικής κινάσης (ένζυμα που ενεργοποιούν πρωτεΐνες) στην tyrosine (ΚΙΤ inhibitors):
Μερικά παραδείγματα της ομάδας είναι η Imatinib–Glivec για χρόνια μυελογενή λευχαιμία, ορισμένους καρκίνους του γαστρεντερικού κλπ., η Gefitinib–Iressa για ορισμένους καρκίνους του πνεύμονα, η Sunitinib-Sutent για καρκίνο του νεφρού και ορισμένους καρκίνους του γαστρεντερικού, η Osimertinib–Tagrisso για αρχική θεραπεία σε ορισμένους καρκίνους του πνεύμονα, η Ibrutinib–Imbruvica για χρονία λεμφοκυτταρική λευχαιμία κλπ.
# Άλλα είναι αναστολείς ενζύμων CDK (Cyclin-dependent kinase). Αυτά δεν αφήνουν να ενεργοποιηθεί το σύμπλεγμα κυκλίνης- CDK, οπότε προκαλούν θάνατο του καρκινικού κυττάρου γιατί δεν το αφήνουν να ξεπεράσει τη φάση G1 του κυτταρικού κύκλου.
Μερικά παραδείγματα είναι η Abemaciclib-Verzenio, η Palbociclib–Ibrance, η Ribociclib–Kisqali, η Lapatinib–Tykerb. Και τα 4 χρησιμοποιούνται για ορισμένους τύπους καρκίνου του μαστού.
# Άλλα είναι αναστολείς της πρωτεϊνικής κινάσης στη serine/threonine, π.χ. η Everolimus–Afinitor (αναστολέας mTOR) για διάφορους καρκίνους.
# Άλλα είναι αναστολείς του πρωτεασώματος (μόριο που διασπά πρωτεΐνες, π.χ. την πρωτεΐνη ρ 53 που προκαλεί κυτταρικό θάνατο) όπως η Bortezomib-Velcade για το πολλαπλούν μυέλωμα.
β) Θεραπευτικά μονοκλωνικά αντισώματα
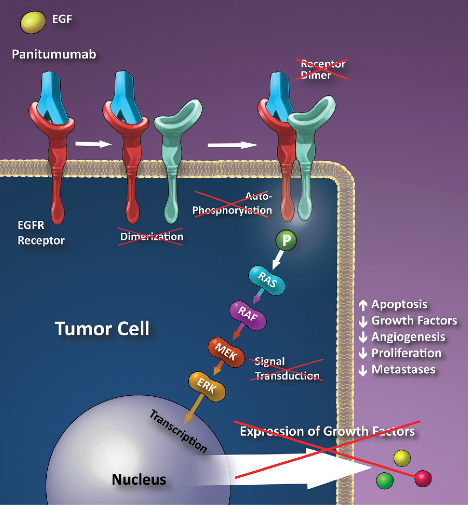
i) Παραδείγματα θεραπευτικών μονοκλωνικών αντισωμάτων που αναστέλλουν υποδοχείς παραγόντων ανάπτυξης στην επιφάνεια του καρκινικού κυττάρου (π.χ. EGFR inhibitors):
Trastuzumab–Herceptin, για καρκίνο μαστού θετικό στον υποδοχέα HER2.
Panitumumab– Vectibix, για μεταστατικό καρκίνο του παχέως εντέρου.
Cetuximab–Erbitux, για μεταστατικό καρκίνο του παχέως εντέρου, μερικούς μεταστατικούς καρκίνους του πνεύμονα, της κεφαλής και του λαιμού.
ii) Παραδείγματα θεραπευτικών μονοκλωνικών αντισωμάτων που αναστέλλουν τη δημιουργία νέων αγγείων (ανταγωνιστές VEGF – vascular endothelial growth factor inhibitors). Αυτά αυξάνουν την αρτηριακή πίεση :
Bevacizumab–Avastin, για καρκίνο του παχέως εντέρου, του πνεύμονα, του νεφρού, για γλοιοβλάστωμα.
Ramucirumab–Cyramza, για καρκίνο γαστρικό και της γαστρο-οισοφαγικής ένωσης.
https://www.mycancergenome.org/content/page/overview-of-targeted-therapies-for-cancer/
Η ΧΗΜΕΙΟΘΕΡΑΠΕΙΑ
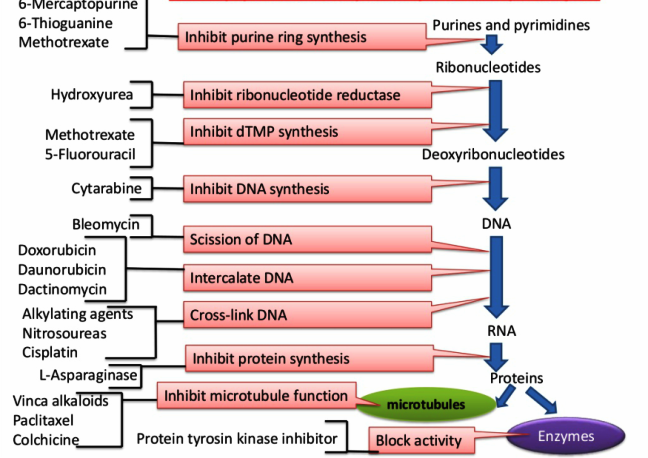
Η χημειοθεραπεία εμποδίζει τη διαίρεση των κυττάρων με διάφορους τρόπους, όπως με βλάβη στο DNA τους ή με βλάβη μηχανισμών που συμμετέχουν στην κυτταρική διαίρεση, οπότε τα κύτταρα πεθαίνουν.
Δυστυχώς η χημειοθεραπεία σκοτώνει γενικά όλα τα κύτταρα που διαιρούνται γρήγορα (κυτταροτοξική), έτσι σκοτώνει τόσο τα καρκινικά όσο και τα υγιή κύτταρα που διαιρούνται συχνά. Αφού ολοκληρωθεί η χημειοθεραπεία, τα υγιή κύτταρα που επηρεάστηκαν, πολλές φορές αναρρώνουν.
Τα υγιή κύτταρα που επηρεάζονται περισσότερο από τη χημειοθεραπεία είναι αυτά που βρίσκονται στο μυελό των οστών, συνεπώς μπορεί να υπάρξουν λοιμώξεις (δυστυχώς οι περισσότερες οφείλονται στους μικροοργανισμούς που υπάρχουν ήδη στο γαστρεντερικό σύστημα και στο δέρμα) από μείωση των λευκών αιμοσφαιρίων, αιμορραγίες από μείωση των αιμοπεταλίων και αναιμία από μείωση των ερυθρών αιμοσφαιρίων.
Επίσης επηρεάζονται τα κύτταρα του βλεννογόνου του γαστρεντερικού συστήματος οπότε συχνά εμφανίζονται ξηροστομία ή πληγές στο στόμα, δυσκολία στην κατάποση, ναυτία- εμετός, διάρροια ή δυσκοιλιότητα, των θυλάκων των τριχών οπότε εμφανίζεται τριχόπτωση κλπ.
Λόγω πολλών από τις πιο πάνω κυτταροτοξικές δράσεις της χημειοθεραπείας ο ασθενής παρουσιάζει γενική εξάντληση.
Επίσης επηρεάζονται από αυτήν τα περιφερικά νεύρα με μουδιάσματα και πόνους, η καρδιά κλπ.
Τα συμπτώματα από την τοξικότητα στα υγιή κύτταρα μπορεί να εμφανιστούν άμεσα ή να καθυστερήσουν και μήνες.
Οι πιο ευαίσθητοι καρκίνοι στη χημειοθεραπεία είναι ο καρκίνος των όρχεων, τα λεμφώματα, ο καρκίνος του τραχήλου της μήτρας, ο τροφοβλαστικός καρκίνος και ο καρκίνος των ωοθηκών.
Έχει υπολογιστεί ότι η συμμετοχή της χημειοθεραπείας στην 5ετή επιβίωση των καρκινοπαθών γενικά, είναι μικρή, μικρότερη από 5%, ανάλογα βέβαια και με το είδος του καρκίνου και το στάδιο του (τοπικός, με διείσδυση σε γειτονικούς ιστούς ή και με απομακρυσμένες μεταστάσεις).
Μια από τις αιτίες της αποτυχίας της χημειοθεραπείας είναι η αντίσταση που αναπτύσσουν τα καρκινικά κύτταρα σ’ αυτήν (με διάφορους μηχανισμούς).
Πάντως επειδή η χημειοθεραπεία συνήθως χρησιμοποιείται διαδοχικά ή και ταυτόχρονα με άλλες θεραπείες είναι δύσκολο να καθοριστεί ποιο είναι το όφελος από τη χρησιμοποίηση της.
Είναι γνωστό ότι η πλειοψηφία των ασθενών που έχουν καρκίνο προχωρημένου σταδίου ή/και καρκίνο υψηλού κινδύνου δυστυχώς θα αποβιώσουν λόγω μεταστάσεων (φανερών ή κρυφών) ή παρενεργειών της χημειοθεραπείας.
Έτσι λόγω των αναπόφευκτων παρενεργειών της χημειοθεραπείας, πρέπει αυτή να χρησιμοποιείται μόνο όπου αναμένεται μεγαλύτερο όφελος συγκριτικά με τη ζημιά.
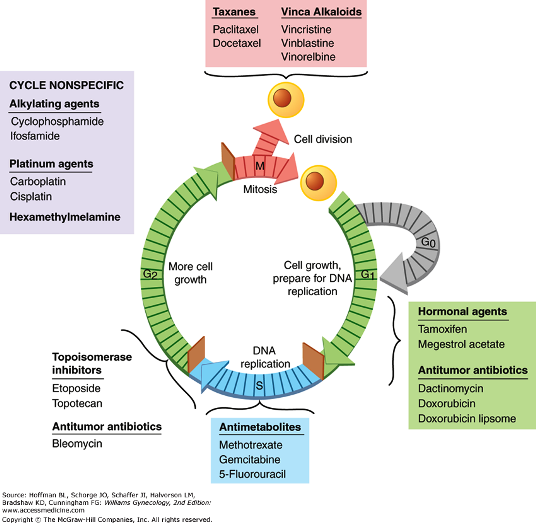
ΟΙ ΟΜΑΔΕΣ ΤΩΝ ΧΗΜΕΙΟΘΕΡΑΠΕΥΤΙΚΩΝ
Χρησιμοποιούνται πάνω από 100 χημειοθεραπευτικά φάρμακα και αυτά ταξινομούνται σε διάφορες κατηγορίες που οι κυριότερες είναι οι πιο κάτω:
Α) Τα Φυτικά Αλκαλοειδή ή φάρμακα εναντίον των μικροσωληνίσκων ή αναστολείς της μίτωσης:
Αυτά εμποδίζουν την κυτταρική διαίρεση μέσω παρέμβασης στη λειτουργία των μικροσωληνίσκων (spindle fibers).
Μερικά παραδείγματα φυτικών αλκαλοειδών είναι:
Τα Αλκαλοειδή της Vinca: Vincristine, Vinblastine και οι Ταξάνες: Paclitaxel and Docetaxel.
Β) Οι Αλκυλιωτικοί παράγοντες ή παράγοντες που προκαλούν βλάβη στο DNA:
Αυτοί ενώνονται με το DNA (μέσω της αλκυλικής ομάδας τους) και έτσι το εμποδίζουν από την αντιγραφή, οπότε σταματά η κυτταρική διαίρεση.
Μερικά παραδείγματα τους είναι:
Τα παράγωγα αερίου Μουστάρδας (π.χ. Cyclophosphamide, Chlorambucil, Melphalan), οι Νιτροζουρίες (π.χ. Carmustine, Lomustine. Αυτά χρησιμοποούνται και για όγκους στον εγκέφαλο), τα άλατα Πλατίνας (π.χ. Carboplatin, Cisplatin, Oxaliplatin), οι Τριαζίνες (π.χ. Temozolomide) κλπ.
Γ) Οι Αντιμεταβολίτες:
Αυτοί μοιάζουν με τις δομικές μονάδες του DNA (και του RNA), οπότε όταν τους χρησιμοποιούν τα κύτταρα αντί των κανονικών δικών τους (π.χ. στη φάση S της αντιγραφής του DNA), το αντίγραφο του DNA γίνεται ελαττωματικό και έτσι δεν μπορεί να διαιρεθεί το κύτταρο.
Μερικά παραδείγματα τους είναι:
Οι ανταγωνιστές των πυριδιμινών (π.χ. 5-Fluorouracil, Cytarabine), οι ανταγωνιστές των πουρινών (π.χ. 6-Mercaptopurine, 6-Thioguanine), οι ανταγωνιστές του Φoλικού οξέως (π.χ. : Methotrexate) κλπ.
[Η Μεθοτρεξάτη (MTX) σταματά η σύνθεση και επιδιόρθωση του DNA μέσω ανταγωνισμού με το Φολικό Οξύ. Αυτό γίνεται γιατί διαταράσσει τη σύνθεση των βάσεων του DNA, μπλοκάροντας ένζυμα (DHFR) που σχετίζονται με τη βιταμίνη Φολικό Οξύ (οπότε σταματά η παραγωγή THF)]
Δ) Τα Αντικαρκινικά Αντιβιοτικά:
Αυτά παράγονται από τον στρεπτομύκητα και σταματούν την κυτταρική διαίρεση μέσω διακοπής της έλικας του DNA από σχηματισμό ελευθέρων ριζών Οξυγόνου ή μέσω ένωσης τους στην έλικα του DNA.
Μερικά παραδείγματα τους είναι:
Οι Ανθρακυκλίνες (π.χ. Doxorubicin, Daunorubicin), Χλωρομυκίνες (π.χ. Actinomycin-D) και η Bleomycin.
[Η Actinomycin-D συνδέεται – παρεμβάλλεται στην ένωση των βάσεων G–C στο DNA και εμποδίζει το άνοιγμα της διπλής έλικας του, έτσι δεν συμβαίνει η αντιγραφή της έλικας του DNA σε αγγελιοφόρο ή messenger RNA (m-RNA), στον πυρήνα (transcription)]
Ε) ΟΙ αναστολείς των τοπο-ισομερασών:
Αυτοί προκαλούν διακοπή της αντιγραφής του DNA, λόγω υπερ-ελίκωσης της διπλής έλικας του, μετά από το σημείο που αυτή ανοίγει για να γίνει η αντιγραφή.
Μερικά παραδείγματα τους είναι:
Αναστολείς της Τοπο-ισομεράσης Ι: Ironotecan, Topotecan
Αναστολείς της Τοπο-ισομεράσης ΙΙ: Etoposide, Teniposide
Ζ) Διάφορα άλλα μοναδικά χημειοθεραπευτικά:
Μερικά παραδείγματα τους είναι:
Η Υδροξυουρία- Hydroxyurea (Ribonucleotide reductase inhibitor), η Mitotane (αναστολέας κορτικοειδών) κλπ.
https://chemocare.com/chemotherapy/what-is-chemotherapy/types-of-chemotherapy.aspx
Η ΟΡΜΟΝΟΘΕΡΑΠΕΙΑ χρησιμοποιείται κυρίως για ορισμένους ορμονοευαίσθητους καρκίνους του προστάτη και του μαστού και δρα στερώντας την ορμόνη που χρειάζονται τα καρκινικά κύτταρα για να πολλαπλασιαστούν.
Μερικά από τα φάρμακα εμποδίζουν τις ορμόνες να δρούν στα κύτταρα, συμπεριλαμβανομένων και των καρκινικών κυττάρων, ενώ άλλα εμποδίζουν την παραγωγή των ορμονών.
Η ΟΡΜΟΝΟΘΕΡΑΠΕΙΑ ΤΟΥ ΚΑΡΚΙΝΟΥ ΜΑΣΤΟΥ
Τα καρκινικά κύτταρα των ορμονο-ευαίσθητων καρκίνων του μαστού (περίπου το 80% των περιπτώσεων) έχουν υποδοχείς των ορμονών (hormone receptor positive ή HR positive) Οιστρογόνων (ή/και Προγεστερόνης) που “ενεργοποιούν” γονίδια που σχετίζονται με τη δημιουργία του καρκίνου.
Έτσι για τους ορμονο-ευαίσθητους καρκίνους μπορεί να χρησιμοποιηθεί η ορμονοθεραπεία με 3 διαφορετικούς τρόπους:
Είτε σαν συμπληρωματική θεραπεία για καρκίνο σε αρχικό στάδιο μετά από εγχείρηση (π.χ. η Tamoxifen–Nolvadex αρχικά για 2-3 χρόνια και μετά ένας αναστολέας του ενζύμου αρωματάση για ακόμη 2-3 χρόνια).
είτε σαν συμπληρωματική θεραπεία για καρκίνο σε προχωρημένο στάδιο ή με μετάσταση (π.χ. η Letrozole-Femara μαζί με στοχευμένη θεραπεία με Lapatinib-Tykerb ή με Palbociclib-Ibrance)
είτε σαν θεραπεία πριν από εγχείρηση (neoadjuvant therapy). Η τελευταία δεν έχει εγκριθεί ακόμη από τον FDA.
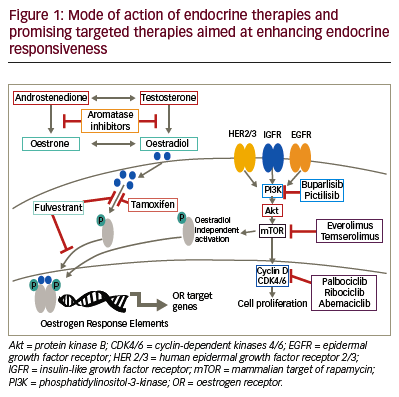
Στο ανωτέρω σχεδιάγραμμα φαίνεται η δράση ορμονικών θεραπειών και στοχευμένων θεραπειών στον καρκίνο του μαστού
# Υπάρχουν διάφοροι τρόποι για να μην “ενεργοποιούνται” γονίδια που σχετίζονται με τη δημιουργία του καρκίνου μέσω των HR positive υποδοχέων:
Α) Με διακοπή της λειτουργίας των ωοθηκών σε προ-εμμηνοπαυσιακές γυναίκες, ώστε να μην παράγονται οιστρογόνα.
Αυτό μπορεί να γίνει με 3 τρόπους, είτε με χειρουργική αφαίρεση των ωοθηκών είτε με καταστροφή τους με ραδιοθεραπεία είτε με φάρμακα που καταπιέζουν τις ωοθήκες για να μην παράγουν οιστρογόνα π.χ. το Goserelin–Zoladex και το Leuprolide–Lupron.
(Αυτά δρουν στην υπόφυση σαν αγωνιστές των υποδοχέων GnRH, καταστέλλοντας τελικά, σε επόμενη φάση, την παραγωγή οιστρογόνων τεστοστερόνης).
Β) Αποκλείοντας τη δράση των οιστρογόνων με ανταγωνιστές των οιστρογονικών υποδοχέων στα καρκινικά κύτταρα:
i) Με “καθαρούς” ανταγωνιστές των οιστρογόνων π.χ. η Fulvestrant–Faslodex. Επιπλέον με αυτήν μαρκάρεται το καρκινικό κύτταρο για καταστροφή.
ii) Με Εκλεκτικούς τροποποιητές των οιστρογονικών υποδοχέων (Selective estrogen receptor modulatorsή SERMs).
Αυτοί ενώνονται με τους υποδοχείς οιστρογόνων και έτσι εμποδίζουν τα οιστρογόνα από το να ενωθούν με αυτούς τους υποδοχείς. Έτσι στο μαστό δρουν σαν ανταγωνιστές των οιστρογόνων, ενώ σε άλλους ιστούς (π.χ. μήτρα, οστά) μπορεί να δρουν σαν αγωνιστές οιστρογόνων (σαν τα οιστρογόνα).
Παραδείγματα SERMs είναι η “παλιά” Tamoxifen–Nolvadex και η Toremifene–Fareston.
Η Tamoxifen χρησιμοποιείται για τις γυναίκες πριν και μετά την εμμηνόπαυση (επίσης για καρκίνο μαστού στον άντρα).
Η Toremifene χρησιμοποιείται για γυναίκες μετά την εμμηνόπαυση.
[Χρειάζεται προσοχή με τα αντικαταθλιπτικά που είναι εκλεκτικοί αναστολείς της επαναπρόσληψης Σεροτονίνης (SSRIs) γιατί μειώνουν τη δράση της Tamoxifen (αυτή είναι προφάρμακο) μέσω μείωσης της δράσης του ενζύμου CYP2D6 του ήπατος που την “ενεργοποεί”).
Παραδείγματα SSRIs είναι η Paroxetine (Seroxat), η Fluoxetine (Ladose), η Sertraline (Zoloft).
Επίσης ορισμένοι τύποι του γονιδίου CYP2D6 που έχουν μερικές γυναίκες, προκαλούν μικρότερη μετατροπή της Tamoxifen στο ενεργό φάρμακο της, οπότε έχουμε και μειωμένη αποτελεσματικότητα της.]
Γ) Με διακοπή της παραγωγής οιστρογόνων στις ωοθήκες (και σε άλλους ιστούς). Αυτοί είναι αναστολείς του ενζύμου αρωματάση (aromatase inhibitors) και χρησιμοποιούνται κυρίως σε γυναίκες μετά την εμμηνόπαυση.
Παραδείγματα τους είναι η Anastrozole–Arimidex, η Letrozole–Femara και η Exemestane–Aromasin (η τελευταία είναι ισχυρότερη και χρησιμοποιείται μετά από τη λήψη Tamoxifen).
Η ΠΡΟΛΗΨΗ ΤΟΥ ΚΑΡΚΙΝΟΥ ΤΟΥ ΜΑΣΤΟΥ ΣΕ ΓΥΝΑΙΚΕΣ ΜΕ ΑΥΞΗΜΕΝΟ ΚΙΝΔΥΝΟ ΓΙ’ ΑΥΤΟΝ
Για πρόληψη του καρκίνου του μαστού σε γυναίκες με αυξημένο κίνδυνο* γι’ αυτόν, έχουν εγκριθεί η Tamoxifen (χρησιμοποιείται πριν και μετά εμμηνόπαυση) και η Raloxifene–Evista (χρησιμοποιείται μετά την εμμηνόπαυση.
[Η Raloxifene χρησιμοποιείται κυρίως για οστεοπόρωση, σε γυναίκες μετά την εμμηνόπαυση (δεύτερη επιλογή μετά τα διφωσφονικά).]
Επίσης για την πρόληψη έχουν δοκιμαστεί με καλά αποτελέσματα και ορισμένοι αναστολείς του ενζύμου αρωματάση.
* Αυξημένος κίνδυνος υπάρχει σε μεγάλη Ηλικία, Παχυσαρκία, κατανάλωση Αλκοόλ, Κάπνισμα, Μεταλλάξεις ορισμένων γονιδίων (π.χ. του BRCA1 και 2), Οικογενειακό ιστορικό καρκίνου του μαστού, λήψη Οιστρογόνων ή προγεστερόνης κατά τη διάρκεια της ζωής, ορισμένες Καλοήθεις παθήσεις του μαστού, Ακτινοθεραπεία μαστού κλπ.
Ο κίνδυνος για καρκίνο του μαστού υπολογίζεται σε εργαλείο του Αμερικανικού Εθνικού Ινστιτούτου Καρκίνου (NCI) στη διεύθυνση: https://bcrisktool.cancer.gov/calculator.html
Η ορμονοθεραπεία του καρκίνου του μαστού φαίνεται στην ιστοσελίδα του Αμερικανικού Ινστιτούτου Καρκίνου (NCI):
https://www.cancer.gov/types/breast/breast-hormone-therapy-fact-sheet
Η ΟΡΜΟΝΟΘΕΡΑΠΕΙΑ ΤΟΥ ΚΑΡΚΙΝΟΥ ΤΟΥ ΠΡΟΣΤΑΤΗ
Η ορμονοθεραπεία του καρκίνου του προστάτη φαίνεται στην ιστοσελίδα του Αμερικανικού Ινστιτούτου Καρκίνου (NCI):
https://www.cancer.gov/types/prostate/prostate-hormone-therapy-fact-sheet
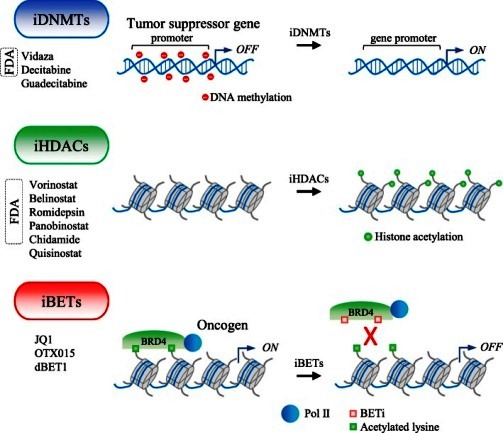
ΤΑ ΕΠΙΓΕΝΕΤΙΚΑ ΦΑΡΜΑΚΑ
Τα επιγενετικά φάρμακα δρουν στα επιγενετικά ένζυμα και κατατάσσονται βάσει της δράσης τους σ’ αυτά.
Δυστυχώς όμως οι δράσεις τους δεν είναι ειδικές, δηλαδή πέρα από τη επαναλειτουργία των tumor suppressor genes που είχαν “σιωπήσει” παθολογικά, μπορεί να επαναλειτουργήσουν και τα γονίδια που προκαλούν καρκίνο.
Έχουν εγκριθεί μόνο τρεις ομάδες επιγενετικών φαρμάκων προς το παρόν, οι αναστολείς της μεθυλίωσης του DNA (DNA Methylation inhibitors ή iDNMTs), οι αναστολείς της απο-ακετυλίωσης των Ιστονών (Histone Deacetylase inhibitors ή iHDACs) και οι αναστολείς EZH2.
https://jbiomedsci.biomedcentral.com/articles/10.1186/s12929-021-00721-x
Φάρμακα από τρεις ομάδες μπορεί να συγχορηγηθούν και επιπλέον να συγχορηγηθούν και με ανοσοθεραπευτικά φάρμακα ή και χημειοθεραπευτικά φάρμακα.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8993057/
Παραδείγματα των αναστολέων της μεθυλίωσης του DNA (iDNMTs) είναι:
Το Azacitidine-Vidaza και το Decitabine-Dacogen. Και τα δυο χρησιμοποιούνται κυρίως για το μυελοδυσπλαστικό σύνδρομο (MDS).
Παραδείγματα των αναστολέων της απο-ακετυλίωσης των Ιστονών (iHDACs) είναι:
Το Panobinostat-Farydak σε συνδυασμό με το Bortezomib–Velcade (μικρομοριακός αναστολέας) για ορισμένους τύπους πολλαπλού μυελώματος.
Το Vorinostat-Zolinza για ένα ειδικό λέμφωμα, το cutaneous T cell lymphoma ή CTCL.
Το Belinostat-Beleodaq για ένα ειδικό λέμφωμα, το peripheral T cell lymphoma ή PTCL.
Το Romidepsin-Istodax για λέμφωμα CTCL και το λέμφωμα PTCL.
Αναστολέας EZH2 (histone methyltransferase inhibitor): Τazemetostat για τη θεραπεία του επιθηλιοειδούς σαρκώματος και του follicular Λεμφώματος.