Η ΠΗΞΗ ΤΟΥ ΑΙΜΑΤΟΣ – Η ΑΙΜΟΣΤΑΣΗ – Η ΘΡΟΜΒΩΣΗ ΚΑΙ ΟΙ ΘΡΟΜΒΟΦΙΛΙΕΣ
Χωρίς το αίμα δεν μπορεί να υπάρξει ζωή. Το αίμα μέσω των αγγείων μεταφέρει Οξυγόνο, θρεπτικά συστατικά, ορμόνες και άλλες ουσίες σε όλα τα κύτταρα του σώματος και παραλαμβάνει τα άχρηστα προϊόντα τους για επεξεργασία και αποβολή.
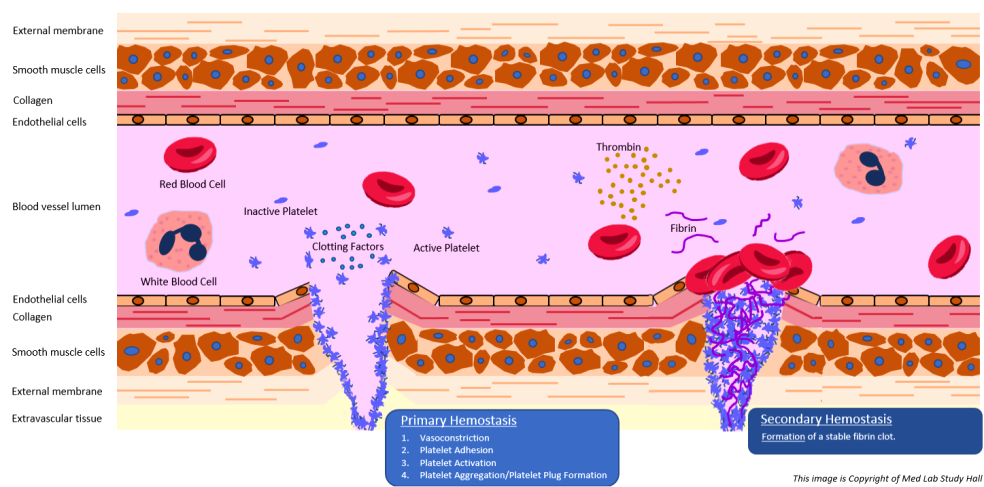
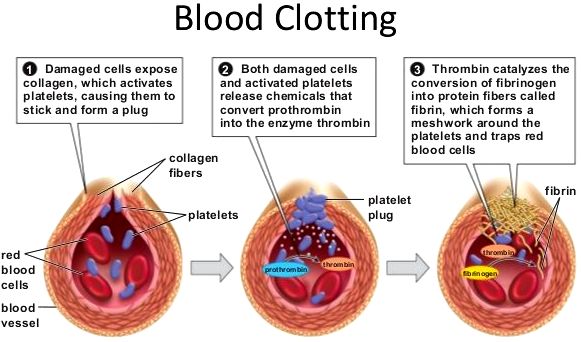
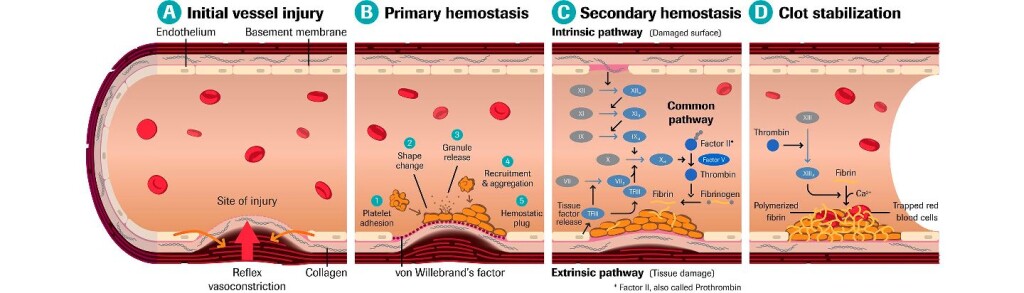
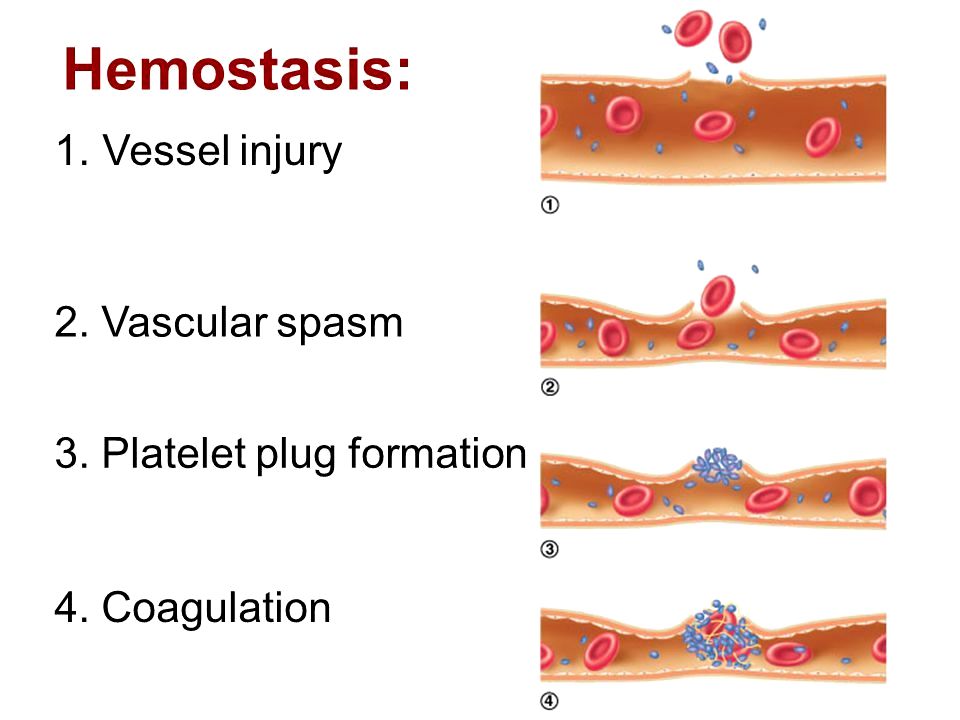
Σε περίπτωση τραυματισμού ή εσωτερικής αιμορραγίας, ο οργανισμός προστατεύεται από την έξοδο αίματος από τα αγγεία, μέσω του μηχανισμού της πήξεως. Έτσι το αίμα μετατρέπεται από υγρή σε στέρεα μορφή, τον θρόμβο, ο οποίος προκαλεί την ΑΙΜΟΣΤΑΣΗ (το σταμάτημα της αιμορραγίας).
Στην αιμόσταση ο θρόμβος που δημιουργείται δρα σαν φελλός σφραγίζοντας το σημείο που έχει τραυματιστεί το αγγείο, ώστε να σταματήσει να ρέει το αίμα έξω από αυτό π.χ. σε περίπτωση εξωτερικού τραυματισμού ή αιμορραγίας από κάποιο σύστημα, π.χ. το γαστρεντερικό, το ουροποιητικό κλπ.
Όταν υπάρξει ΒΛΑΒΗ ΤΟΥ ΕΝΔΟΘΗΛΙΟΥ (η εσωτερική επίστρωση των αγγείων) το αίμα έρχεται σε επαφή με ουσίες κάτω από αυτό.
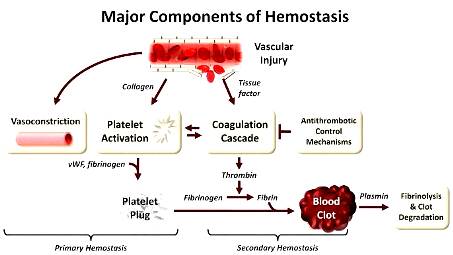
Έτσι αμέσως ξεκινούν ορισμένες δράσεις που προκαλούν την ΑΙΜΟΣΤΑΣΗ:
# Ο σπασμός του αγγείου.
[Αυτός γίνεται από την Ενδοθηλίνη 1 (εκκρίνεται από τα ενδοθηλιακά κύτταρα που έχουν βλάβη), την Θρομβοξάνη Α2 (ΤΧ-Α2) και τη Σεροτονίνη (οι δυο τελευταίες εκκρίνονται από τα ενεργοποιημένα αιμοπετάλια).] (Δες πιο κάτω)
# Τα αιμοπετάλια (θρομβοκύτταρα).
Αυτά είναι τα αιμοστατικά κύτταρα του αίματος που παράγονται συνεχώς από τα μεγακαρυοτικά κύτταρα του μυελού των οστών και ζουν περίπου για 10 μέρες.
# Τα κύτταρα που παράγουν τον Ιστικό Παράγοντα (Tissue factor ή TF ή F ΙΙΙ) (Δες πιο κάτω)
# Οι υπόλοιποι παράγοντες της πήξεως. (Δες πιο κάτω)
[ΤΑ ΑΝΤΙΘΡΟΜΒΩΤΙΚΑ ΦΑΡΜΑΚΑ (ΑΝΤΙΑΙΜΟΠΕΤΑΛΙΑΚΑ ΚΑΙ ΑΝΤΙΠΗΚΤΙΚΑ ΦΑΡΜΑΚΑ)
α) Τα αντιαιμοπεταλιακά φάρμακα δρουν εμποδίζοντας τη συγκόλληση – συσσώρευση των αιμοπεταλίων και της δημιουργίας του αρχικού μαλακού αιμοπεταλιακού θρόμβου.
### Για τα αντιαιμοπεταλιακά φάρμακα επισκεφθείτε το αντίστοιχο άρθρο: ΤΑ ΑΝΤΙΑΙΜΟΠΕΤΑΛΙΑΚΑ ΦΑΡΜΑΚΑ
β) Τα αντιπηκτικά φάρμακα δρουν αναστέλλοντας (άμεσα ή έμμεσα) παράγοντες της πήξεως με τελικό αποτέλεσμα να μην σχηματιστεί το πλέγμα του ινώδους και ο τελικός στέρεος θρόμβος.
### Για τα αντιπηκτικά επισκεφθείτε το αντίστοιχο άρθρο: ΤΑ ΑΝΤΙΠΗΚΤΙΚΑ ΦΑΡΜΑΚΑ]
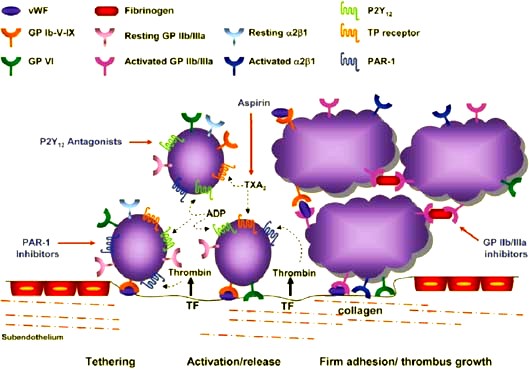
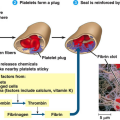
Ο ΑΙΜΟΠΕΤΑΛΙΑΚΟΣ ΘΡΟΜΒΟΣ – Η ΑΡΧΙΚΗ ΠΡΟΣΩΡΙΝΗ ΑΙΜΟΣΤΑΣΗ
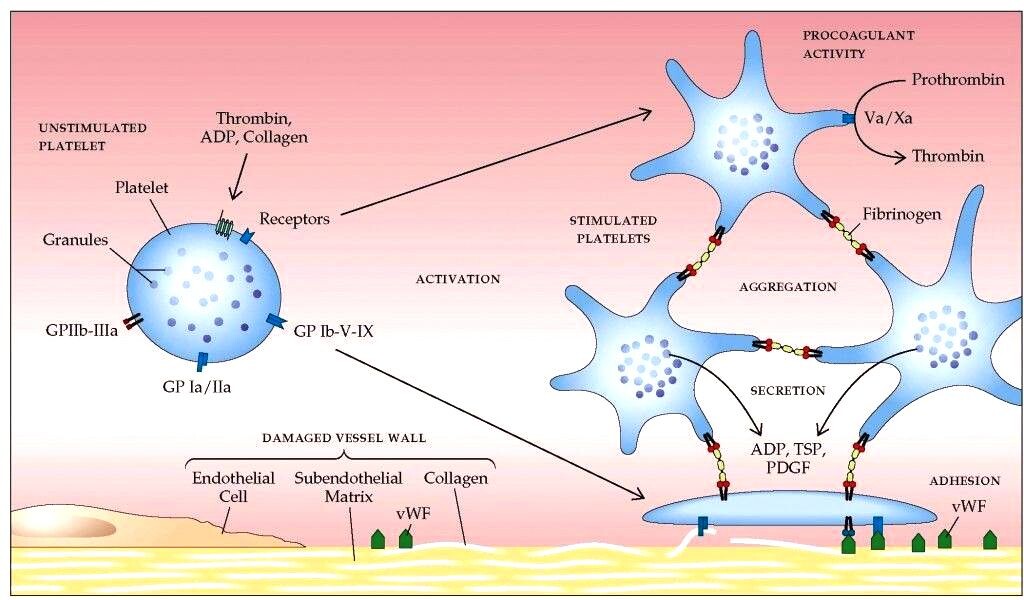
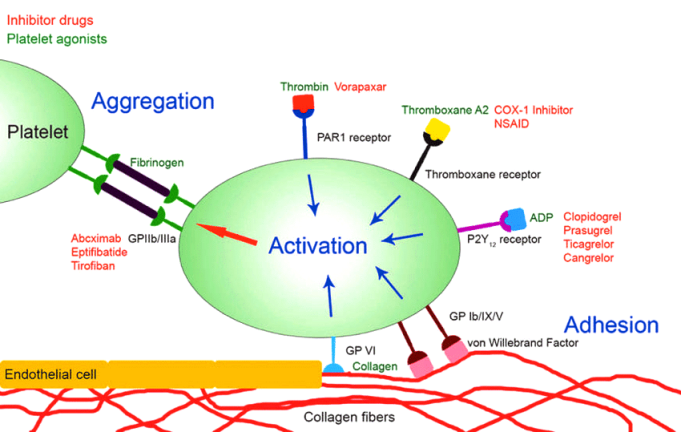
Η δημιουργία του θρόμβου ξεκινά a) με την προσκόλληση αιμοπεταλίων στο κολλαγόνο κάτω από το τραυματισμένο ενδοθήλιο, b) συνεχίζεται με την ενεργοποίηση των αιμοπεταλίων και μετά c) με την συγκόλληση (αλληλοένωση) πολλών αιμοπεταλίων μέσω μορίων ινωδογόνου, οπότε δημιουργείται αρχικά ο λευκός μαλακός προσωρινός αιμοπεταλιακός θρόμβος. (Δες πιο κάτω)
Ο ΤΕΛΙΚΟΣ ΣΤΕΡΕΟΣ ΘΡΟΜΒΟΣ – Η ΔΕΥΤΕΡΟΓΕΝΗΣ ΑΙΜΟΣΤΑΣΗ
Ο στέρεος τελικός ερυθρός θρόμβος δημιουργείται με μια σειρά διαδοχικών ενζυματικών αντιδράσεων από τους παράγοντες της πήξεως ώστε να απλωθεί ένα τρισδιάστατο πλέγμα ινώδους μέσα στον αιμοπεταλιακό θρόμβο που θα τον ισχυροποιήσει. (Δες πιο κάτω)
Οι παράγοντες της πήξεως συντίθενται στο ήπαρ εκτός από τον παράγοντα VIII (8) και τον Ιστικό Παράγοντα που συντίθενται στα κύτταρα του ενδοθηλίου. Έτσι αν υπάρχει ανεπάρκεια του ήπατος έχουμε εύκολα αιμορραγίες.
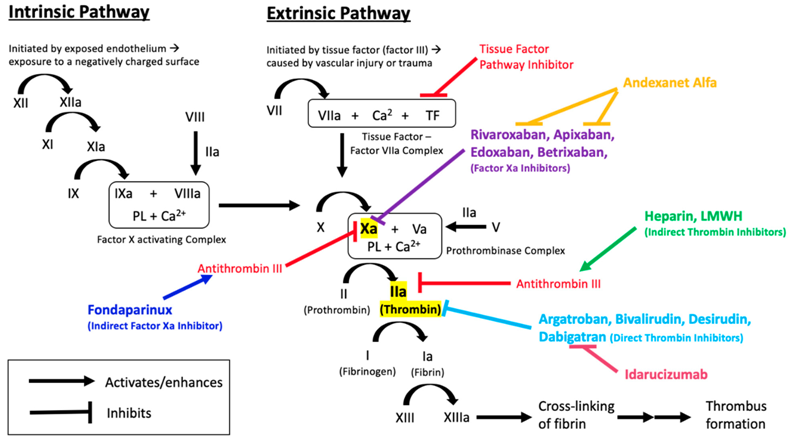
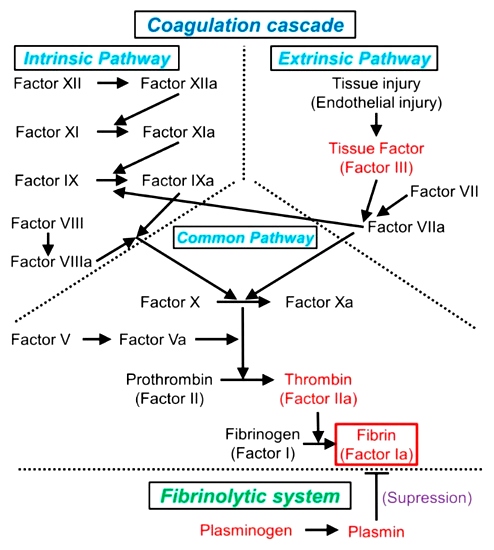
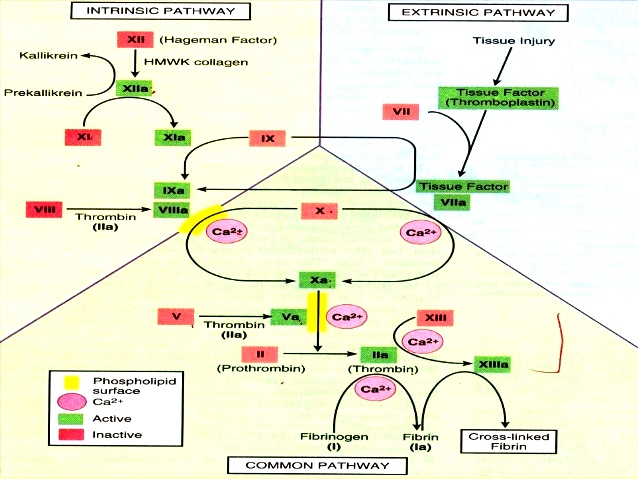
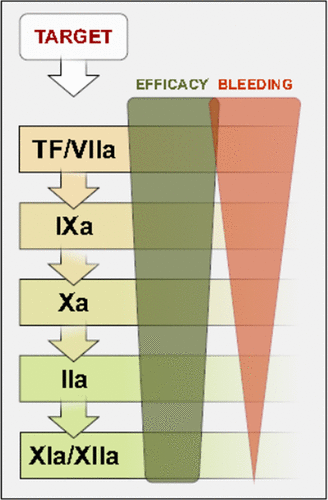
Το πλέγμα του ινώδους μέσα στον αιμοπεταλιακό θρόμβο δημιουργείται με δυο τρόπους, ή δρόμους. Αυτοί ονομάστηκαν μονοπάτια της πήξεως και είναι το εξωτερικό μονοπάτι που είναι και το σπουδαιότερο και το εσωτερικό μονοπάτι.
# Στο ΕΞΩΤΕΡΙΚΟ ΜΟΝΟΠΑΤΙ η διαδικασία ξεκινά όταν ο παράγοντας της πήξεως VII (7) του αίματος έρχεται σε επαφή με τον Ιστικό Παράγοντα (Tissue factor ή TF) που φυσιολογικά παράγεται κυρίως από κύτταρα έξω από το αγγείο. (Δες πιο κάτω)
# Στο ΕΣΩΤΕΡΙΚΟ ΜΟΝΟΠΑΤΙ η διαδικασία ξεκινά όταν ο παράγοντας της πήξεως ΧΙΙ (12) του αίματος, λόγω εσωτερικής βλάβης του αγγείου, έρχεται σε επαφή με το κολλαγόνο που βρίσκεται κάτω από το ενδοθήλιο.
Το εσωτερικό μονοπάτι (ενδογενής οδός) σχετίζεται με την πήξη του αίματος κυρίως υπό την έννοια της επέκτασης και σταθεροποίησης του θρόμβου (η μεγαλύτερη ποσότητα θρομβίνης προέρχεται από το εσωτερικό μονοπάτι). (Δες πιο κάτω)
Επίσης φαίνεται ότι το εσωτερικό μονοπάτι σχετίζεται και με το εγγενές ανοσοποιητικό σύστημα και με τη φλεγμονή.
# Λόγω της μεγάλης σημασίας του εξωτερικού μονοπατιού, υπάρχει η άποψη ότι ο διαχωρισμός σε εξωτερικό και εσωτερικό μονοπάτι μάλλον πρέπει να αντικατασταθεί από τον όρο μονοπάτι του ιστικού παράγοντα (ΤF).
ΟΙ ΚΑΤΑΣΤΑΣΕΙΣ ΠΟΥ ΔΗΜΙΟΥΡΓΟΥΝ ΘΡΟΜΒΟ
Είναι ευνόητο ότι χωρίς την δημιουργία θρόμβων δεν θα ζούσαμε, λόγω υπερβολικής αιμορραγίας από τραυματισμούς ή από εσωτερικές παθολογικές αιμορραγίες, έτσι η ΦΥΣΙΟΛΟΓΙΚΗ θρόμβωση στις αρτηρίες και φλέβες προκαλεί την αιμόσταση όπου ο θρόμβος δρα σφραγίζοντας το σημείο που έχει τραυματιστεί το αγγείο.
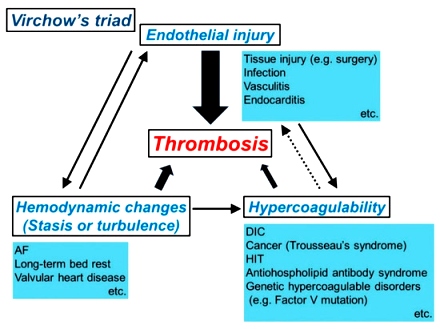
# Η θρόμβωση ευνοείται από ορισμένες καταστάσεις όπως η στάση ή στροβιλώδης ροή του αίματος, η βλάβη του ενδοθηλίου και η υπερπηκτικότητα του αίματος (τριάδα Virchow).
Όμως δυστυχώς υπάρχουν ορισμένες καταστάσεις που η δημιουργία του θρόμβου προκαλεί σοβαρό ιατρικό πρόβλημα στον άνθρωπο.
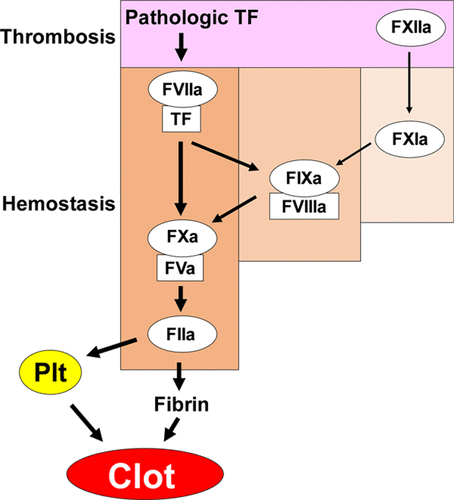
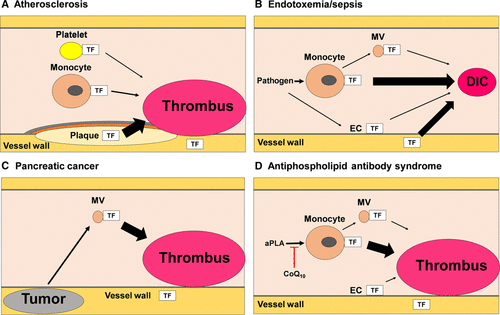
# Η ΠΑΘΟΛΟΓΙΚΗ θρόμβωση σε αρτηρίες και φλέβες πυροδοτείται είτε από τη “μη φυσιολογική” παραγωγή του Ιστικού παράγοντα (TF) π.χ. από τα αφρώδη μακροφάγα της αθηρωματικής πλάκας, από τα κύτταρα του ενδοθηλίου, τα μονοκύτταρα, τα αιμοπετάλια κλπ. είτε από το εσωτερικό μονοπάτι της πήξεως. (Δες πιο κάτω)
Η παθολογική θρόμβωση δημιουργείται σε ορισμένες καταστάσεις όπως:
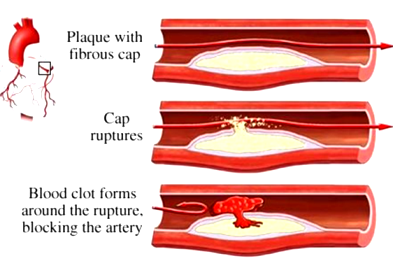
α) Από ΑΘΗΡΩΜΑΤΙΚΗ πλάκα σε αρτηρία.
Η δημιουργία θρόμβου που δημιουργείται λόγω αθηρωματικής πλάκας οφείλεται σε ρήξη ή διάβρωση του ενδοθηλίου πάνω από αυτήν και είναι η αφορμή για την δημιουργία ορισμένων επικινδύνων για τη ζωή καταστάσεων όπως των Οξέων Στεφανιαίων Συνδρόμων (έμφραγμα STEMI και N-STEMI), αν η πλάκα βρίσκεται σε στεφανιαία αρτηρία ή Ισχαιμικών Εγκεφαλικών επεισοδίων, αν η πλάκα βρίσκεται σε αρτηρία του εγκεφάλου ή στην έσω καρωτίδα.
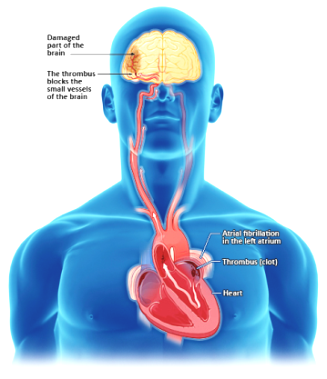
β) Από Κολπική μαρμαρυγή. Η Κολπική μαρμαρυγή δημιουργεί βραδεία κυκλοφορία και περιδίνηση του αίματος ιδίως στο ωτίο του αριστερού κόλπου.
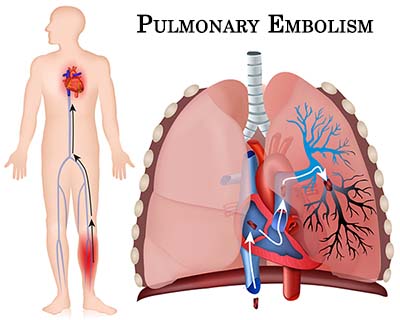
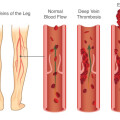
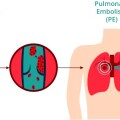
γ) Από βραδεία κυκλοφορία του αίματος στις φλέβες οπότε δημιουργείται η θρομβοφλεβίτιδα και πνευμονική εμβολή.
Η εν τω βάθει θρομβοφλεβίτιδα και η επακόλουθη πνευμονική εμβολή μπορεί να δημιουργηθούν από προσωρινή αιτία του προηγούμενου 3μήνου όπως μεγάλη εγχείρηση με πολυήμερη ακινησία ή από χρονιότερη αιτία π.χ. από καρκίνο.
δ) Από καταστάσεις υπερπηκτικότητας του αίματος (Θρομβοφιλίες), όπως είναι η έλλειψη πρωτεΐνης C, η έλλειψη πρωτεΐνης S, η έλλειψη Αντιθρομβίνης, από το Αντιφωσφολιπιδικό σύνδρομο, από μετάλλαξη Leiden του παράγοντα της πήξεως V (5) κλπ. (Δες πιο κάτω)
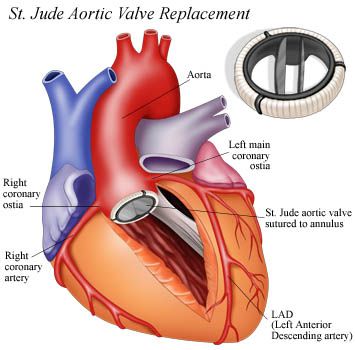
ε) Από ύπαρξη τεχνητής μηχανικής βαλβίδας στην καρδιά π.χ. σε αντικατάσταση στενωμένης αορτικής βαλβίδας.
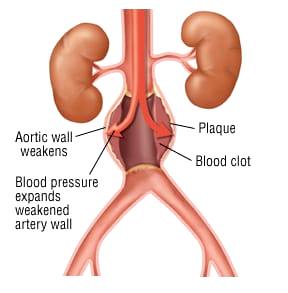
ζ) Από περιδίνηση του αίματος σε ανεύρυσμα αρτηρίας π.χ. της κοιλιακής αορτής.
Η ΙΣΟΡΡΟΠΙΑ ΘΡΟΜΒΟΓΕΝΕΣΗΣ ΘΡΟΜΒΟΔΙΑΛΥΣΗΣ ΣΤΟΝ ΟΡΓΑΝΙΣΜΟ
Σε φυσιολογικές συνθήκες στο εσωτερικό των αγγείων υπάρχει μια λεπτή συνεχής ισορροπία μεταξύ θρομβογένεσης και θρομβοδιάλυσης που η μεν πρώτη προκαλεί τη δημιουργία, η δε δεύτερη τη διάλυση των θρόμβων..
Έτσι ο οργανισμός πρέπει να ισορροπεί από τη μια μεταξύ επικίνδυνων αιμορραγιών (αν το αίμα δεν έχει επαρκή πηκτικότητα) και από την άλλη από αύξηση των θρομβώσεων (αν το αίμα έχει αυξημένη πηκτικότητα).
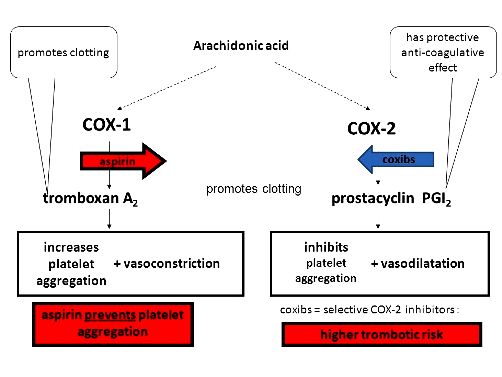
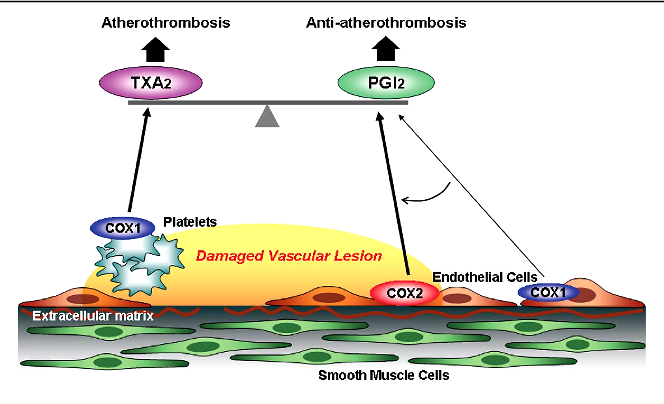
## Η θρομβογένεση και θρομβοδιάλυση του ΑΙΜΟΠΕΤΑΛΙΑΚΟΥ θρόμβου γίνεται μέσω των αντίθετα δρώντων προσταγλανδινών, της Θρομβοξάνης Α2 και της Προστακυκλίνης Ι2.
[Η Θρομβοξάνη Α2 (ΤΧ-Α2) παράγεται από τα αιμοπετάλια, μέσω της κυκλοοξυγενάσης-1 (COX1) και προκαλεί αγγειοσυστολή και δημιουργία θρόμβων (αυξάνει τη συσσώρευση των αιμοπεταλίων).
Η Προστακυκλίνη Ι2 (PG-I2) παράγεται από το υγιές ενδοθήλιο των αγγείων, μέσω της κυκλοοξυγενάσης-2 (COX2) και προκαλεί αγγειοδιαστολή και μείωση των θρομβώσεων (μέσω μείωσης της ενεργοποίησης και συσσώρευσης των αιμοπεταλίων)]. (Δες πιο κάτω)
## Στη διαδικασία της θρομβογένεσης και θρομβοδιάλυσης του ΤΕΛΙΚΟΥ ΙΣΧΥΡΟΥ θρόμβου που περιέχει το πλέγμα του ινώδους, συμμετέχει η δημιουργία του ινώδους από την Θρομβίνη από τη μία και η αυτόματη ενδογενής διάλυση του ινώδους από την Πλασμίνη από την άλλη.
[Το Ινώδες είναι το τελικό προϊόν της διαδικασίας της πήξης μέσω των δυο μονοπατιών (εσωτερικού και εξωτερικού) των παραγόντων της πήξεως . Και τα δυο μονοπάτια καταλήγουν μέσω του παράγοντα Χ, στη Θρομβίνη και τελικά στο Ινώδες.] (Δες πιο κάτω)
Ο ΑΥΤΟ-ΠΕΡΙΟΡΙΣΜΟΣ ΤΗΣ ΠΗΞΗΣ
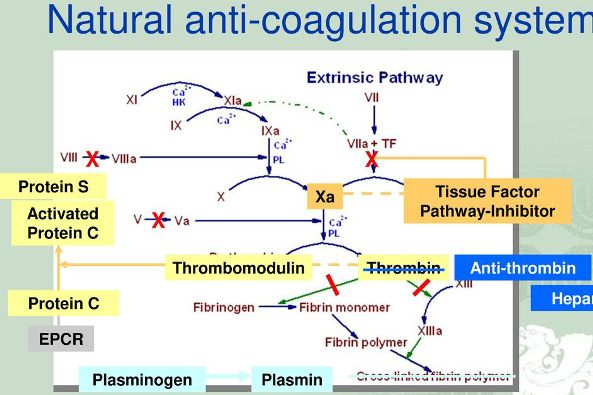
Επειδή η αιμόσταση πρέπει να παραμείνει τοπικά, στο σημείο της αιμορραγίας, και δεν πρέπει να επεκταθεί σε όλο το αίμα, η διαδικασία ελέγχεται στενά με αυτό-περιοριστικούς μηχανισμούς (feedback). Γι’ αυτό προβλέφθηκε να υπάρχουν φυσικοί αναστολείς της πήξεως που δρουν μειώνοντας τη δράση των παραγόντων της πήξεως.
Οι κυριότεροι φυσικοί αναστολείς της πήξεως είναι η Αντιθρομβίνη ΙΙΙ, η πρωτεΐνη C, η πρωτεΐνη S, η πρωτεΐνη Ζ και ο αναστολέας του μονοπατιού του Ιστικού παράγοντα (tissue factor pathway inhibitor ή TFPI).
Η ΤΕΛΙΚΗ ΦΑΣΗ ΤΗΣ ΑΙΜΟΣΤΑΣΗΣ – Η ΙΝΩΔΟΛΥΣΗ
Στο τέλος της αιμόστασης, όταν το αγγείο επουλωθεί, μετά από μερικές μέρες, πρέπει να εξαφανιστεί ο θρόμβος για να αποκατασταθεί η ροή του αίματος. Αυτή η διεργασία επιτυγχάνεται με την ινοδώλυση.
Η εξαφάνιση του θρόμβου γίνεται αρχικά με τη συρρίκνωση του (λόγω σύσπασης των ινιδίων του κυτταροσκελετού των αιμοπεταλίων) και μετά με τη διάλυση του ινώδους από την πλασμίνη (ινωδόλυση).
Η ινωδόλυση ξεκινά σε λίγες ώρες από τον τραυματισμό του αγγείου και διαρκεί 2-3 μέρες.
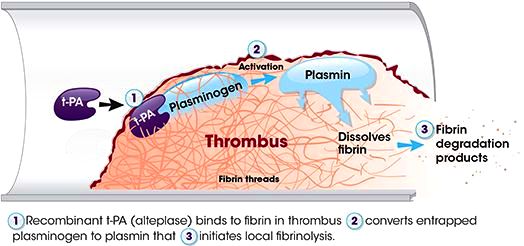
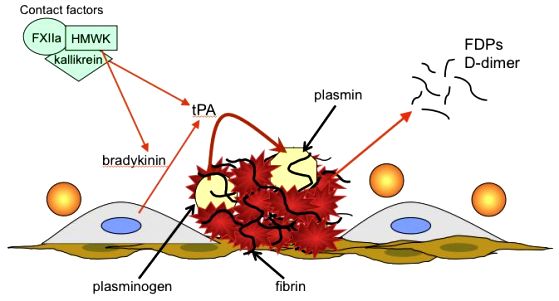
[Η Πλασμίνη δημιουργείται από το Πλασμινογόνο με τη βοήθεια ενζύμων, των ενεργοποιητών του πλασμινογόνου και κυρίως του ιστικού ενεργοποιητή tPA (tissue Ρlasminogen Αctivator) και δευτερευόντως του uΡΑ (urokinase Ρlasminogen Αctivator).]
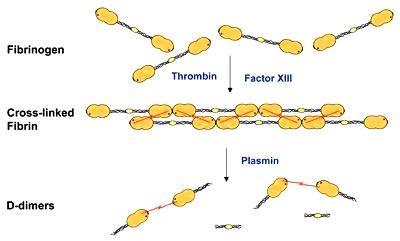
Η Πλασμίνη διαλύει το πλέγμα του ινώδους σε πεπτίδια, τα D-dimers. Το D-dimer είναι το μικρότερο πρωτεϊνικό θραύσμα (FDP – fibrin degradation product) από τη διάλυση του Ινώδους.
Βέβαια η Ινωδόλυση συμβαίνει επίσης και στην παθολογική θρόμβωση (π.χ. πνευμονική εμβολή). Έτσι η εύρεση αυξημένης ποσότητας D-dimers στο αίμα σημαίνει ότι γίνεται διάλυση θρόμβου – θρόμβων που έχουν ήδη δημιουργηθεί.
# Επιπλέον για την πλήρη αποκατάσταση της βλάβης στο τραυματισμένο αγγείο χρειάζεται να αποδομηθούν και οι διάφορες εξωκυτταρικές ουσίες που μαζεύτηκαν προηγουμένως για την αιμόσταση. Αυτό γίνεται από τις Μεταλλοπρωτεΐνάσες του εξωκυττάριου χώρου (ΜΜΡs).
ΜΕ ΛΕΠΤΟΜΕΡΕΙΕΣ
ΟΙ ΘΡΟΜΒΟΦΙΛΙΕΣ
Οι Θρομβοφιλίες είναι καταστάσεις υπερπηκτικότητας του αίματος. Αυτές είναι είτε κληρονομικές είτε εμφανίζονται αργότερα (επίκτητες).
Οι κληρονομικές θρομβοφιλίες οφείλονται σε μετάλλαξη γονιδίου και δημιουργούν θρομβώσεις σε φλέβες (μεγάλο ποσοστό τους δεν είναι γνωστό μέχρι σήμερα:
α) Η μετάλλαξη προκαλεί απώλεια της λειτουργίας της αντίστοιχης πρωτεΐνης, όπως της πρωτεΐνης C, της πρωτεΐνης S, της αντιθρομβίνης κλπ.
Περισσότερα γι’ αυτές υπάρχουν στο άρθρο ΚΛΗΡΟΝΟΜΙΚΕΣ ΘΡΟΜΒΟΦΙΛΙΕΣ – Η ΑΝΕΠΑΡΚΕΙΑ ΤΗΣ ΑΝΤΙΘΡΟΜΒΙΝΗΣ ΙΙΙ, Η ΑΝΕΠΑΡΚΕΙΑ ΤΗΣ ΠΡΩΤΕΪΝΗΣ C, Η ΑΝΕΠΑΡΚΕΙΑ ΤΗΣ ΠΡΩΤΕΪΝΗΣ S
β) Η μετάλλαξη προκαλεί αύξηση της λειτουργίας της αντίστοιχης πρωτεΐνης, όπως του παράγοντα V Leiden και τη μετάλλαξη του γονιδίου G20210A της Προθρομβίνης.
Περισσότερα υπάρχουν στα άρθρα Η ΘΡΟΜΒΟΦΙΛΙΑ ΤΟΥ ΠΑΡΑΓΟΝΤΑ V LEIDEN (FVL) και Η ΜΕΤΑΛΛΑΞΗ ΤΟΥ ΓΟΝΙΔΙΟΥ ΤΗΣ ΠΡΟΘΡΟΜΒΙΝΗΣ (G20210A)
Περισσότερα για τις κληρονομικές θρομβοφιλίες υπάρχουν στο άρθρο ΘΡΟΜΒΟΦΙΛΙΑ – ΟΙ ΚΛΗΡΟΝΟΜΙΚΕΣ ΘΡΟΜΒΟΦΙΛΙΕΣ
Οι επίκτητες θρομβοφιλίες έχουν χαρακτηριστικό παράδειγμα το αντιφωσφολιπιδικό σύνδρομο (antiphospholipid syndrome ή APS).
Το αντιφωσφολιπιδικό σύνδρομο (APS) είναι αυτοάνοση πάθηση, παρατηρείται σε 1: 2000 περίπου άντρες και γυναίκες και προκαλεί θρομβώσεις σε όλα τα αγγεία (αρτηρίες και φλέβες) και επίσης επιπλοκές της εγκυμοσύνης όπως αυτόματες αποβολές ή προεκλαμψία, έλκη στο δέρμα κλπ.
Αυτό μπορεί να προκαλέσει θρομβοεμβολική νόσο, ισχαιμικό εγκεφαλικό επεισόδιο, έμφραγμα, άνοια κλπ.
Το APS πολλές φορές συνυπάρχει με άλλη αυτοάνοση πάθηση, συχνότερα με τον ερυθηματώδη λύκο.
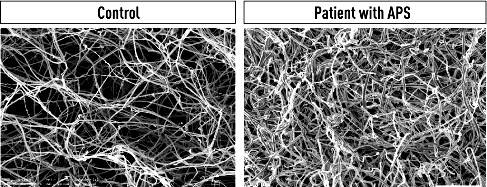
Στο APS το τρισδιάστατο πλέγμα του ινώδους είναι πολύ πυκνότερο και έτσι πιο δύσκολο να διαλυθεί από την ινοδώλυση.
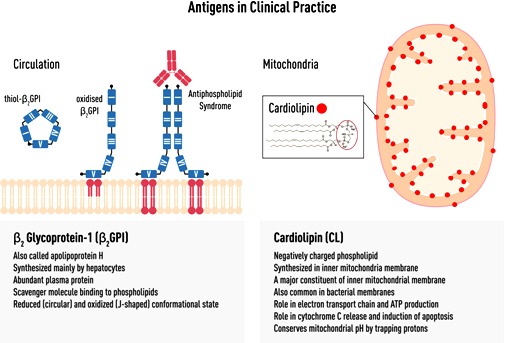
Η διάγνωση του γίνεται από την επίμονη εύρεση στο αίμα, τουλάχιστον ενός από τα τρία : Αντικαρδιολιπινικά αντισώματα (aCL) IgG ή IgM ή/και αντισώματα IgG ή IgM κατά της βήτα 2 γλυκοπρωτεΐνης I (anti–β2GPI) ή/και αντιπηκτικό του λύκου (LA)
Υπ’ όψιν ότι τα αντιφωσφολιπιδικά αντισώματα (aPL ) εμφανίζονται παροδικά στο 3% του πληθυσμού, χωρίς να υπάρχει αντιφωσφολιπιδικό σύνδρομο, ιδίως σε λοιμώξεις, καρκίνο, χρόνια φλεγμονή, μεγάλη ηλικία κλπ.
>> Περισσότερα για το αντιφωσφολιπιδικό σύνδρομο υπάρχουν στο άρθρο ΤΟ ΑΝΤΙΦΩΣΦΟΛΙΠΙΔΙΚΟ ΣΥΝΔΡΟΜΟ (APS)
https://www.ejves.com/article/S1078-5884(20)30868-6/fulltext
https://onlinelibrary.wiley.com/doi/full/10.1111/joim.13022
Ο ΑΙΜΟΠΕΤΑΛΙΑΚΟΣ ΘΡΟΜΒΟΣ ΛΕΠΤΟΜΕΡΩΣ
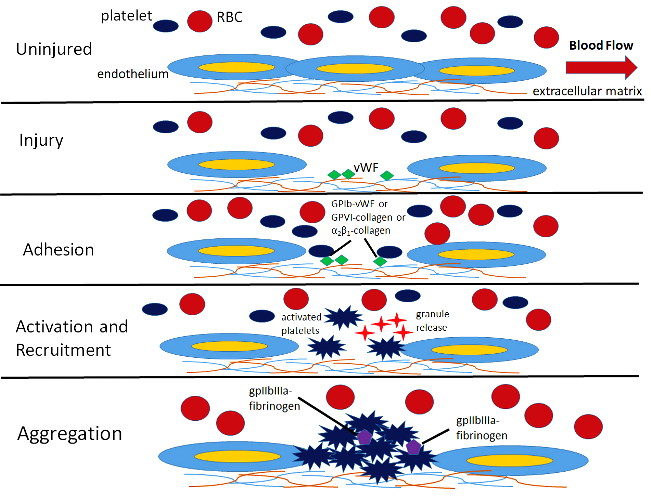
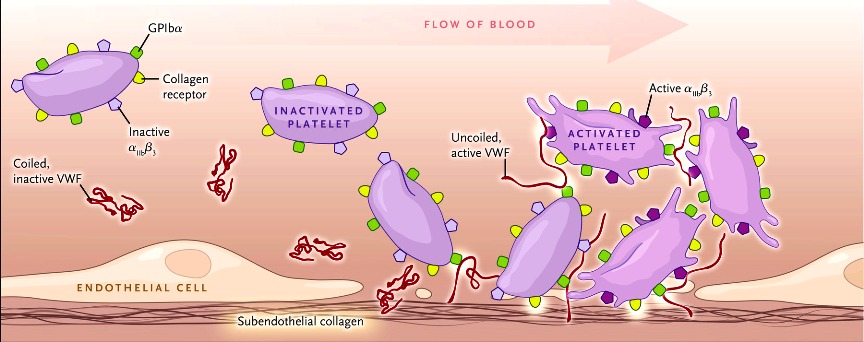
Ο αιμοπεταλιακός θρόμβος ξεκινά με την προσκόλληση των αιμοπεταλίων (ονομάζονται και θρομβοκύτταρα) του αίματος στην περιοχή του τραύματος και ακολούθως η ενεργοποίηση και συσσώρευση τους, οπότε δημιουργείται αρχικά ο λευκός αιμοπεταλιακός θρόμβος.
Η ΠΡΟΣΚΟΛΛΗΣΗ
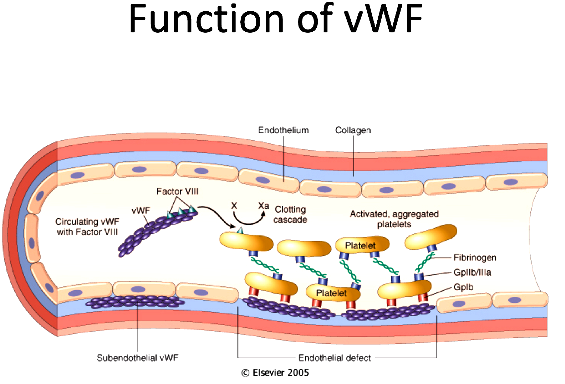
Αν συμβεί βλάβη στο ενδοθήλιο τα αιμοπετάλια που κυκλοφορούν στο αίμα ΠΡΟΣΚΟΛΛΩΝΤΑΙ (adhesion) στην περιοχή κάτω από αυτό, κυρίως στον παράγοντα von Willebrand (vWF), μέσω του υποδοχέα τους Gp Ib (GPIb-IX-V) και ακολούθως στερεότερα στο κολλαγόνο μέσω του υποδοχέα κολλαγόνου GPVI (και του υποδοχέα Ιa/ΙΙa).
[Ο παράγοντα vWF εκκρίνεται από τα κοκκία των αιμοπεταλίων και από τα κύτταρα του ενδοθηλίου. Αυτός κυκλοφορεί στο αίμα σε ανενεργή μορφή και ενεργοποιείται αν έρθει σε επαφή με το κολλαγόνο που βρίσκεται κάτω από τα ενδοθηλιακά κύτταρα.
Ο παράγοντα vWF μεταφέρει επιπλέον και τον παράγοντα της πήξεως VIII (8)]
Η ΕΝΕΡΓΟΠΟΙΗΣΗ
Με την προσκόλληση των αιμοπεταλίων στο κολλαγόνο κάτω από το ενδοθήλιο, απελευθερώνονται ουσίες που τα αιμοπετάλια έχουν ήδη αποθηκευμένες σε κοκκία.
Έτσι αρχίζει η ΕΝΕΡΓΟΠΟΙΗΣΗ των προσκολλημένων αιμοπεταλίων και η επιστράτευση και ενεργοποίηση και άλλων αιμοπεταλίων.
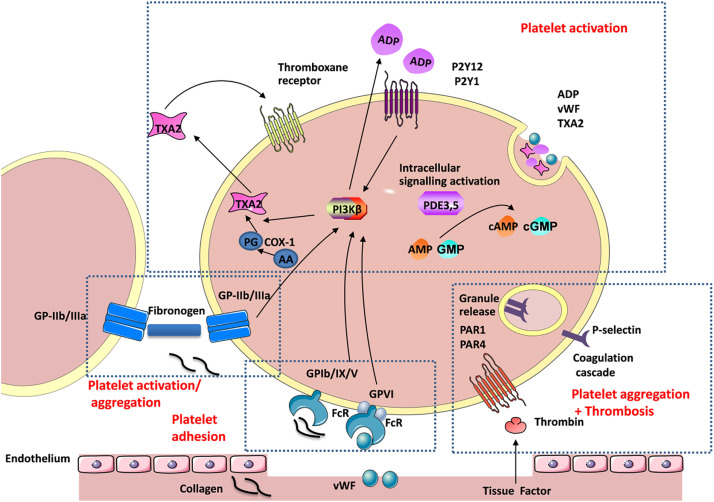
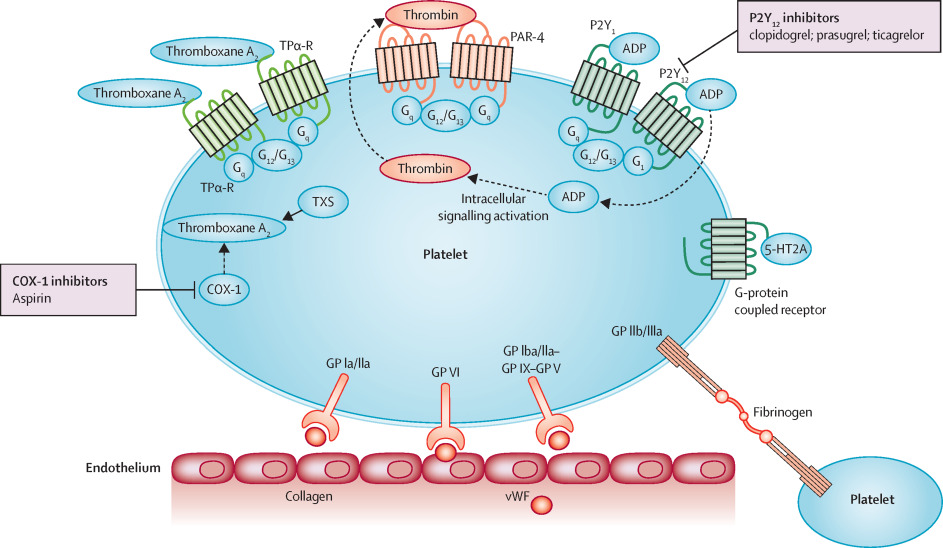
Με την ενεργοποίηση: α) αλλάζει το σχήμα των αιμοπεταλίων (δημιουργούνται προεκτάσεις για να ενωθούν εύκολα μεταξύ τους) λόγω αλλαγής του κυτταροσκελετού τους, β) γίνεται η ενεργοποίηση του τελικού υποδοχέα, GP IIb/IIIa και γ) προκαλείται σύσπαση του αγγείου στην περιοχή της βλάβης.
Η ενεργοποίηση του τελικού υποδοχέα, GP IIb/IIIa, γίνεται μετά από διέγερση ορισμένων άλλων υποδοχέων στην επιφάνεια του αιμοπεταλίου με κυριότερους τους υποδοχείς Θρομβοξάνης Α2 (ΤΧΑ2), τους υποδοχείς ADP (Ρ2Υ-12) και τους υποδοχείς θρομβίνης (PAR-1).
Ορισμένες ουσίες που ελευθερώνονται στο αίμα από τα κοκκία των αιμοπεταλίων, όπως το ADP, η Θρομβοξάνη Α2 (TXA2) δρουν στους αντίστοιχους υποδοχείς στην επιφάνεια του αιμοπεταλίου (το ADP στους υποδοχείς Ρ2Υ και η ΤΧΑ2 στους υποδοχείς Θρομβοξάνης) και επίσης αυτές ενεργοποιούν και εσωτερικά βιοχημικά μονοπάτια του αιμοπεταλίου (PDE/cAMP, PI3K).
Ο υποδοχέας Ρ2Υ 1 αλλάζει το σχήμα του αιμοπεταλίου και ο υποδοχέας Ρ2Υ 12 ενεργοποιεί τον τελικό υποδοχέα, GP IIb/IIIa για να γίνει η συγκόλληση των αιμοπεταλίων.
Επιπλέον ενεργοποιείται απελευθέρωση Αραχιδονικού Οξέως (ΑΑ) από μεμβράνες του αιμοπεταλίου στο εσωτερικό του και από αυτό παράγεται TXA2 με τη βοήθεια του ενζύμου COX 1.
Η ενεργοποίηση των αιμοπεταλίων μετατρέπει τη μεμβράνη τους και σε υπόστρωμα για την μετατροπή της προθρομβίνης (παράγοντας πήξεως ΙΙ) σε θρομβίνη (παράγοντας πήξεως ΙΙa). (Δες πιο κάτω)
Ταυτόχρονα ο Ιστικός παράγοντας (TF) πυροδοτεί (μέσω του εξωτερικού μονοπατιού) την παραγωγή Θρομβίνης.
Η Θρομβίνη δρα τόσο στην παραγωγή του ινώδους όσο και στα αιμοπετάλια που έχουν προσκολληθεί στο σημείο της βλάβης του αγγείου και τα ενεργοποιεί και αυτή μέσω των υποδοχέων PAR-1.
Η ΣΥΓΚΟΛΛΗΣΗ
Η ΣΥΓΚΟΛΛΗΣΗ (aggregation) των αιμοπεταλίων, για τη δημιουργία του λευκού αιμοπεταλιακού θρόμβου γίνεται μετά από ενεργοποίηση του τελικού υποδοχέα, GP IIb/IIIa στην επιφάνεια τους.
Ένα μόριο ινωδογόνου ενώνεται στους υποδοχείς GP IIb/IIIa δυο διαφορετικών αιμοπεταλίων και τα συγκολλά- ενώνει. Πολλά συγκολλημένα αιμοπετάλια δημιουργούν τον αιμοπεταλιακό θρόμβο.
Η ενεργοποίηση του τελικού υποδοχέα, GP IIb/IIIa, γίνεται από τη διέγερση ορισμένων άλλων υποδοχέων στην επιφάνεια του αιμοπεταλίου. Οι κυριότεροι είναι οι υποδοχείς Θρομβοξάνης Α2 (ΤΧΑ2), οι υποδοχείς ADP (Ρ2Υ 12) και οι υποδοχείς θρομβίνης (PAR-1).
[Επιπλέον τα αιμοπετάλια συγκολλούνται και μέσω του παράγοντα von Willebrand που ενώνει τον υποδοχέα Gp Ib ενός αιμοπεταλίου με τον ενεργοποιημένο υποδοχέα GP IIb/IIIa του άλλου αιμοπεταλίου.]
Διαταραχές δημιουργίας του αιμοπεταλικού θρόμβου δημιουργούνται κυρίως αν είναι μειωμένα τα αιμοπετάλια (θρομβοκυτοπενία) ή αν υπάρχει η νόσος του Von Willebrand.
[Στη νόσο του Von Willebrand, ο παράγοντας Von Willebrand είναι κληρονομικά μειωμένος ή μη λειτουργικός, οπότε υπάρχει μειωμένη προσκόλληση και συσσώρευση των αιμοπεταλίων.
Η νόσος του Von Willebrand μεταφέρεται σαν ελαφρά μορφή με αυτοσωματική επικρατούσα κληρονομικότητα από τον γονιό στα παιδιά και παρατηρείται περίπου στο 1% του πληθυσμού.
Όμως στο 1: 8000 πληθυσμού είναι κλινικά σημαντική νόσος και σ’ αυτούς μεταφέρεται με αυτοσωματική υπολειπόμενη κληρονομικότητα.
(Μερικές φορές, σπάνια, η νόσος του Von Willebrand παρατηρείται και χωρίς κληρονομικότητα, π.χ. σε καρκίνους, όπως του πνεύμονα και αιματολογικούς, σε αυτοάνοσες παθήσεις, όπως ερυθηματώδη λύκο και υποθυρεοειδισμό, σε μεταλλικές βαλβίδες στην καρδιά κλπ.)]
ΤΟ ΕΞΩΤΕΡΙΚΟ ΜΟΝΟΠΑΤΙ ΤΗΣ ΠΗΞΕΩΣ ΛΕΠΤΟΜΕΡΩΣ
Για να σχηματιστεί ο τελικός αιμοστατικός ερυθρός θρόμβος χρειάζεται να δημιουργηθεί τρισδιάστατο πλέγμα ινώδους για να ισχυροποιήσει τον αρχικό μαλακό αιμοπεταλιακό θρόμβο.
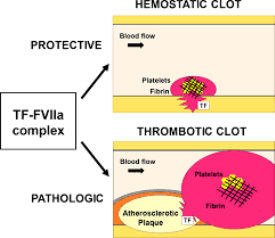
Στο εξωτερικό μονοπάτι η διαδικασία δημιουργίας του ινώδους, ξεκινά όταν ο παράγοντας της πήξεως VII (7) του αίματος έρχεται σε επαφή με τον Ιστικό Παράγοντα (Tissue factor ή TF) που φυσιολογικά παράγεται κυρίως από κύτταρα έξω από το αγγείο.
Ο Ιστικός Παράγοντας* (Tissue factor ή TF) ή F ΙΙΙ, που βρίσκεται κυρίως κάτω από το ενδοθήλιο και έξω από τα αγγεία (εξωτερικό μονοπάτι), ενεργοποιεί τον παράγοντα της πήξεως** F VII (7) που βρίσκεται στο αίμα και στη συνέχεια ενώνεται μαζί του και δημιουργεί το σύμπλεγμα TF + F VIIa.
Ακολούθως το σύμπλεγμα TF+F VIIa, πυροδοτεί την έναρξη της διαδικασίας που δημιουργεί τελικά το πλέγμα ινώδους.
Το πλέγμα του ινώδους ισχυροποιεί τον αρχικό μαλακό αιμοπεταλιακό θρόμβο και έτσι σχηματίζεται ο τελικός αιμοστατικός ερυθρός θρόμβος (λέγεται έτσι γιατί εγκλωβίζονται και ερυθροκύτταρα σ’ αυτόν).
Το σύμπλεγμα TF + F VIIa ενεργοποιεί τόσο τον παράγοντα F X (10) όσο και τον παράγοντα F IX (9), και τον συμπαράγοντα F VIIΙ, και τους μετατρέπει στις ενεργοποιημένες μορφές τους, F Xa, F IXa και F VIIΙa αντίστοιχα.
(Υπ’ όψιν ότι ο παράγοντας F IX (9) και ο συμπαράγοντας F VIIΙ (8) ανήκουν στο λεγόμενο εσωτερικό μονοπάτι της πήξεως, έτσι τελικά ο TF μπορεί να ενεργοποιήσει και τα δύο μονοπάτια της πήξεως)
Στη συνέχεια, στο κοινό μονοπάτι της πήξεως, ο ενεργοποιημένος παράγοντας F Xa (10) ενεργοποιεί (σε σύμπλεγμα μαζί με τον συμπαράγοντα F V) τον παράγοντα F ΙΙ ή Προθρομβίνη σε F ΙΙa ή Θρομβίνη.
Η θρομβίνη*** είναι προσκολλημένη πάνω σε όσα αιμοπετάλια είναι στον αιμοπεταλιακό θρόμβο, ώστε να μην επεκταθεί η πήξη σε όλο το αίμα.
Η θρομβίνη με τη σειρά της ενεργοποιεί τον παράγοντα 1 (F Ι ή Ινωδογόνο) στη δημιουργία του ινώδους (F Ιa).
Το ινώδες ισχυροποιεί τον μαλακό αιμοπεταλιακό θρόμβο, αφού μετατραπεί σε τρισδιάστατο πλέγμα ινώδους με τη βοήθεια του παράγοντα 13 (F XΙΙΙ), και τον μετατρέπει στον τελικό αιμοστατικό θρόμβο.
Η επάρκεια του εξωτερικού μονοπατιού της πήξεως, ελέγχεται με το χρόνο προθρομβίνης (ΡΤ)
[**Οι παράγοντες (F) της πήξεως είναι πρωτεΐνες που κυκλοφορούν στο αίμα σε ανενεργή μορφή και για να είναι αποτελεσματικοί χρειάζονται ιόντα Ασβεστίου (F IV) και τα φωσφολιπίδια των κυτταρικών μεμβρανών.
Οι παράγοντες της πήξεως F VIII και F ΙΙΙ (TF) κυρίως συντίθενται στα κύτταρα του ενδοθηλίου και όλοι οι υπόλοιποι συντίθενται στο ήπαρ.]
[Η θρομβίνη*** παράγεται στην επιφάνεια των ενεργοποιημένων αιμοπεταλίων και πέρα από τη μετατροπή του ινωδογόνου σε ινώδες, επιπλέον ενεργοποιεί τους συμπαράγοντες VIII και V.
Η θρομβίνη συμμετέχει επιπλέον, μαζί την πρωτεΐνη C (που αναστέλλει την πήξη), στην αδρανοποίηση των συμπαραγόντων VIIIa και Va ώστε να μην επεκταθεί η πήξη πέρα από το τραυματισμένο σημείο του αγγείου.]
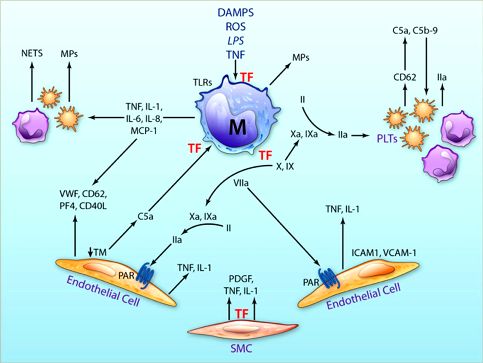
*Ο Ιστικός παράγοντας, TF παράγεται από πολλά κύτταρα: Από τα κύτταρα του ενδοθηλίου, από τα αφρώδη μακροφάγα της αθηρωματικής πλάκας, από κύτταρα έξω από τα αγγεία όπως οι ινοβλάστες και οι λείες μυϊκές ίνες, από τα κερατινοκύτταρα του δέρματος, από τα μυοκύτταρα και τους ινοβλάστες της καρδιάς κλπ.
Ο TF παράγεται και από τα αιμοπετάλια και τα μονοκύτταρα λευκοκύτταρα του αίματος, φαίνεται όμως ότι από αυτά συμμετέχει μόνο σε παθολογική θρόμβωση και όχι σε αιμόσταση.
Υπ’ όψιν ότι ιοί, όπως ο κορωνοϊός SARS-CoV-2 που προκαλεί την COVID 19, προκαλούν παραγωγή TF από πολλά κύτταρα όπως τα μονοκύτταρα και τα ενδοθηλιακά κύτταρα, προκαλώντας θρομβώσεις στα αγγεία.
Η φλεγμονή, τα μονοκύτταρα (M), ο Ιστικός παράγοντας (TF) και η πήξη.
https://www.ahajournals.org/doi/full/10.1161/circresaha.116.306853
ΤΟ ΕΣΩΤΕΡΙΚΟ ΜΟΝΟΠΑΤΙ (Η ΕΝΕΡΓΟΠΟΙΗΣΗ ΑΠΟ ΕΠΑΦΗ)
ΟΛΟΙ ΟΙ ΠΑΡΑΓΟΝΤΕΣ ΓΙΑ ΤΗΝ ΠΗΞΗ ΒΡΙΣΚΟΝΤΑΙ ΜΕΣΑ ΣΤΟ ΑΓΓΕΙΟ
Για να σχηματιστεί ο τελικός ερυθρός θρόμβος χρειάζεται να δημιουργηθεί τρισδιάστατο πλέγμα ινώδους για να ισχυροποιήσει τον αρχικό μαλακό αιμοπεταλιακό θρόμβο.
Στο εσωτερικό μονοπάτι η διαδικασία δημιουργίας του ινώδους, ξεκινά όταν ο παράγοντας F XΙΙ (12) του αίματος ενεργοποιηθεί σε F XΙΙa, από την επαφή του με το κολλαγόνο κάτω από το ενδοθήλιο λόγω του εσωτερικού τραύματος του αγγείου.
Το εσωτερικό μονοπάτι της πήξεως (ενδογενής οδός) φαίνεται ότι σχετίζεται με το εγγενές ανοσοποιητικό σύστημα, με φλεγμονή και με την πήξη του αίματος υπό την έννοια της επέκτασης και σταθεροποίησης του θρόμβου (η μεγαλύτερη ποσότητα θρομβίνης προέρχεται από το εσωτερικό μονοπάτι).
Γι’ αυτό υπάρχει η άποψη ότι μάλλον και τα δύο μονοπάτια πρέπει να αντικατασταθούν από τον όρο μονοπάτι του ιστικού παράγοντα (ΤF)
https://journals.sagepub.com/doi/full/10.1177/1076029616673733
https://www.sciencedirect.com/science/article/pii/S0163725819301366
Το εσωτερικό μονοπάτι της πήξεως ξεκινά από τραύμα στο ενδοθήλιο (η εσωτερική επικάλυψη του αγγείου), με την ενεργοποίηση του παράγοντα F XΙΙ σε F XΙΙa, από την επαφή του με το κολλαγόνο κάτω από το ενδοθήλιο, λόγω εσωτερικού τραύματος του αγγείου. [Στην αντίδραση συμμετέχουν και ενδοθηλιακά κύτταρα, το κινινογόνο HMWK και η προκαλλικρείνη (που μετατρέπεται σε καλλικρείνη)]
[Επίσης ενεργοποίηση του F XΙΙ πιθανώς συμβαίνει και από πολυφοσφωρικές ουσίες (polyphosphate ή polyP) που εκκρίνονται από τα ενεργοποιημένα αιμοπετάλια. [αυτές ενεργοποιούν επιπλέον και τον παράγοντα 11 της πήξεως (F XΙ)].
Επιπλέον ενεργοποίηση του F XΙΙ φαίνεται ότι συμβαίνει και από την επαφή του με μόρια RNA και DNA και ακόμη και από τη μεμβράνη των ενεργοποιημένων αιμοπεταλίων.
https://www.ahajournals.org/doi/full/10.1161/CIRCRESAHA.117.310939
https://www.ahajournals.org/doi/10.1161/ATVBAHA.118.312130
Στη συνέχεια ο ενεργοποιημένος παράγοντας F XΙΙa ενεργοποιεί τον παράγοντα F XΙ (11). Αυτός με τη σειρά του ενεργοποιεί τον παράγοντα F ΙX (9) και ακολούθως αυτός ενεργοποιεί τον συμπαράγοντα F VIIΙ (8).
Η κατάληξη είναι ότι το σύμπλεγμα του F ΙXa και του συμπαράγοντα F VIIΙa, ενεργοποιούν τον παράγοντα F Xa (10), πάνω στην επιφάνεια του αιμοπεταλίου, και ακολουθεί η πορεία του κοινού μονοπατιού (δες πιο πάνω) που θα καταλήξει τελικά στο τρισδιάστατο πλέγμα του ινώδους και τον τελικό ισχυρό αιμοστατικό ερυθρό θρόμβο.
# Η επάρκεια του εσωτερικού μονοπατιού της πήξεως, ελέγχεται με το χρόνο ενεργοποιημένης μερικής θρομβοπλαστίνης (αΡΤΤ)
Οι αρχικοί παράγοντες ΧΙΙ και ΧΙ του εσωτερικού μονοπατιού σχετίζονται κυρίως με την παθολογική θρόμβωση και ελάχιστα με την αιμόσταση, οπότε γίνεται προσπάθεια για δημιουργία φαρμάκων που να αποκλείουν τη δράση τους, για να σταματούν τις παθολογικές θρομβώσεις χωρίς να δημιουργείται αιμορραγία.
ΟΙ ΑΙΜΟΡΡΟΦΙΛΙΕΣ
Η συχνότερη συγγενής (εκ γενετής) αιμορραγική διαταραχή που αφορά τους παράγοντες πήξεως είναι η αιμορροφιλία Α που οφείλεται σε μείωση του παράγοντα VIII (8) και παρατηρείται σε 1: 5.800 γεννήσεις αγοριών. Αυτές προκαλούν αυτόματες αιμορραγίες κυρίως στις αρθρώσεις και στους μυς.
Πιο σπάνια είναι η αιμορροφιλία Β που παρουσιάζεται περίπου σε 1: 25.000 γεννήσεις αγοριών και οφείλεται σε μείωση του παράγοντα ΙΧ (9).
Και οι δύο οφείλονται σε μετάλλαξη στο αντίστοιχο γονίδιο που δημιουργεί τον παράγοντα της πήξεως και το γονίδιο βρίσκεται στο χρωμόσωμα Χ. Έτσι αυτές παρατηρούνται σε οικογένειες και μεταφέρονται με φυλοσύνδετη υπολειπόμενη κληρονομικότητα, υπάρχουν όμως και περιπτώσεις που η μετάλλαξη είναι καινούργια, συνεπώς δεν υπάρχει κληρονομικό ιστορικό.
Η αιμορροφιλίες Α και Β μεταδίδονται από τη μητέρα φορέα με πιθανότητα 50% στα παιδιά τους. Στα αγόρια η πιθανότητα είναι 50% να υπάρχει η νόσος αιμορροφιλία (αυτά έχουν μόνο ένα Χ χρωμόσωμα) και στα κορίτσια η πιθανότητα είναι 50% να είναι φορείς.
Οι άντρες που έχουν τη νόσο αιμορροφιλία μεταφέρουν το ελαττωματικό γονίδιο κατά 100% στα κορίτσια τους που όμως είναι μόνο φορείς. Στα αγόρια τους δεν μεταφέρεται καθόλου (λαμβάνουν μόνο το χρωμόσωμα Υ από τον πατέρα).
(Οι αιμορροφιλίες που οφείλονται σε άλλους παράγοντες πήξεως είναι πολύ σπανιότερες με συχνότερη αυτήν που αφορά τον παράγοντα VII που παρατηρείται σε 1: 500.000 τόσο σε αγόρια, όσο και σε κορίτσια και μεταφέρονται με αυτοσωματική υπολειπόμενη κληρονομικότητα.)