ΟΙ ΙΟΙ ΚΑΙ ΤΟ ΑΝΟΣΟΠΟΙΗΤΙΚΟ ΣΥΣΤΗΜΑ
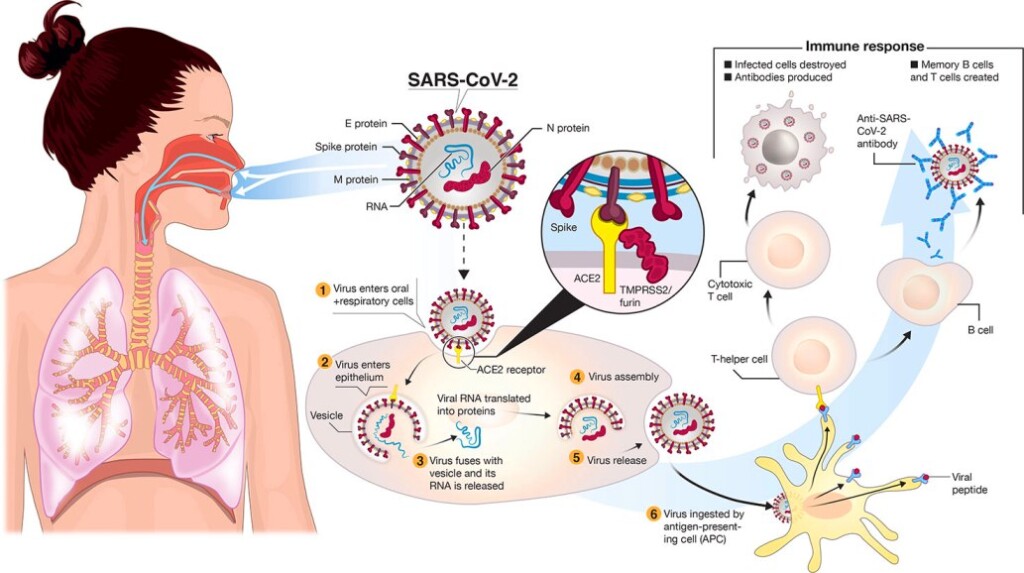
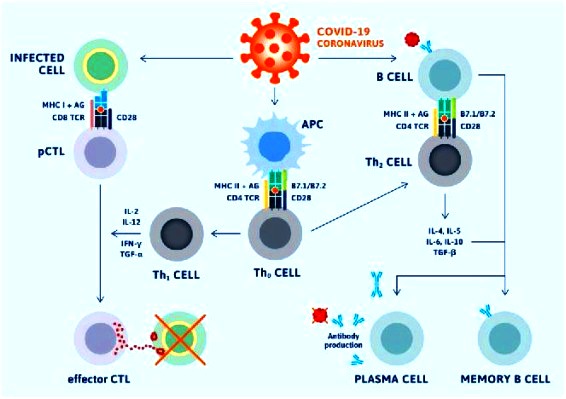
Όταν εισβάλει ένας ιός, όπως ο SARS-CoV-2 (που προκαλεί την COVID-19) στα κύτταρα του σώματος, ξεκινούν να ενεργοποιούνται μηχανισμοί άμυνας από το ανοσοποιητικό σύστημα, για την εξόντωση του.
[Οι ιοί είναι μικροσκοπικοί παθογόνοι οργανισμοί που αναπαράγονται μόνο σε ζωντανά κύτταρα ζώων, φυτών, βακτηρίων κλπ., τα οποία και καταστρέφουν.
Αυτοί βρίσκονται στα όρια της ζωής των εμβίων όντων και φαίνεται ότι υπήρχαν από την αρχή της εξέλιξης των πρώτων ζώντων κυττάρων, πριν ακόμη το διαχωρισμό τους στα αρχαία, τα βακτήρια και τα ευκαρυωτικά κύτταρα.
Οι ιοί έπαιξαν κεντρικό ρόλο στην αρχική εξέλιξη (μεταφέροντας γονίδια μεταξύ διαφορετικών ειδών) και στη γενετική ποικιλομορφία.
Αυτοί περιλαμβάνουν εκατομμύρια διαφορετικά είδη και διαχωρίζονται κυρίως από το αν έχουν στο εσωτερικό τους γενετικό υλικό RNA ή DNA.]
### Όταν ένας ιός εισέλθει σε ένα κύτταρο το εξαναγκάζει, χρησιμοποιώντας τα υλικά του, να κατασκευάσει χιλιάδες αντίγραφα του, τα οποία στη συνέχεια μολύνουν άλλα κύτταρα.
>> Η άμυνα απέναντι στους ιούς ξεκινά αρχικά από το εγγενές ανοσοποιητικό σύστημα με τις Ιντερφερόνες το σύστημα του συμπληρώματος και επιπλέον από τα φυσικά φονικά κύτταρα (NK cells) και τα Δενδριτικά κύτταρα.
>>> Στη συνέχεια, μετά από μερικές μέρες, αρχίζει να δρα το επίκτητο ανοσοποιητικό σύστημα με τα Τ λεμφοκύτταρα και τα Β λεμφοκύτταρα.
Η ΕΓΓΕΝΗΣ ΑΝΟΣΙΑ
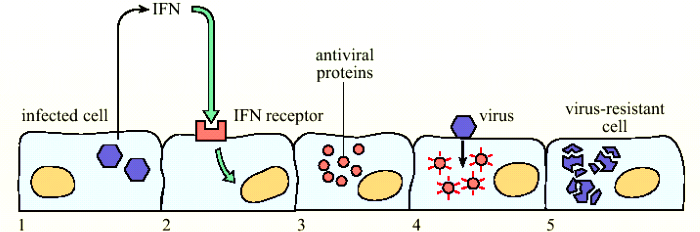
Α) Η πρώτη γραμμή άμυνας ξεκινά από τις ΙΝΤΕΡΦΕΡΟΝΕΣ (IFNs).
Οι IFNs δημιουργούνται κυρίως στα κύτταρα που μολύνθηκαν από τον ιό (π.χ. επιθηλιακά των βλεννογόνων) και από κύτταρα του ανοσοποιητικού συστήματος όπως μακροφάγα, φυσικά φονικά κύτταρα κλπ.
Οι Ιντερφερόνες σταματούν τον πολλαπλασιασμό αρκετών ειδών ιών στα μολυσμένα κύτταρα, προστατεύουν τα γειτονικά κύτταρα και επιστρατεύουν για βοήθεια αμυντικά κύτταρα της εγγενούς ανοσίας (π.χ. δενδριτικά κύτταρα, φυσικά φονικά κύτταρα) και της επίκτητης ανοσίας (Τ λεμφοκύτταρα και Β λεμφοκύτταρα).
[Όταν ο ιός μπει στα κύτταρα μας, αναγνωρίζεται από ειδικούς υποδοχείς PRRs, οπότε αρχίζει η παραγωγή Ιντερφερονών.
> Αυτές προκαλούν την παραγωγή πρωτεϊνών από πολλά γονίδια που λέγονται Interferon Stimulated Genes (ή ISGs).
>> Οι πρωτεΐνες των ISGs δρουν εναντίον όλων των σταδίων του ιού, από την είσοδο, την αντιγραφή και την έξοδο του από το μολυσμένο κύτταρο.]
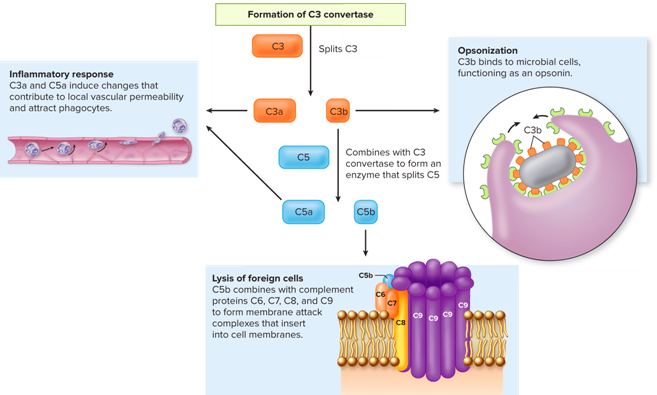
Β) Το ΣΥΣΤΗΜΑ ΤΟΥ ΣΥΜΠΛΗΡΩΜΑΤΟΣ, δρα κατά των ιών με διάφορους μηχανισμούς: α) Αυξάνει τη φαγοκυττάρωση των ιών (κυρίως από τα μακροφάγα και τα ουδετερόφιλα), β) μέσω του συμπλέγματος MAC καταστρέφει, ανοίγει τρύπα, στο περίβλημα μερικών ιών με περίβλημα (enveloped viruses) και στο περίβλημα κυττάρων που μολύνθηκαν από τον ιό και γ) Από το σύστημα του συμπληρώματος ενισχύεται η δράση των Τ και Β Λεμφοκυττάρων (επίκτητη ανοσία).
Η ενίσχυση της φαγοκυττάρωσης γίνεται από πρωτεΐνες του συμπληρώματος, όπως η C3b, που χρησιμεύει σαν ενδιάμεσο μόριο (οπότε λέγεται οψωνίνη) που ενώνεται με τον ιό ώστε να εντοπιστεί και εξουδετερωθεί από τα φαγοκύτταρα.
Όμως αν υπερ- αντιδράσει το σύστημα του συμπληρώματος, τότε γίνεται ζημιά στο σώμα από αυξημένη φλεγμονή (π.χ. σε μικρό ποσοστό των ανθρώπων με COVID 19).
Γ) Ταυτόχρονα, ενεργοποιούνται τα φυσικά φονικά κύτταρα, τα Δενδριτικά κύτταρα και τα Β λεμφοκύτταρα.
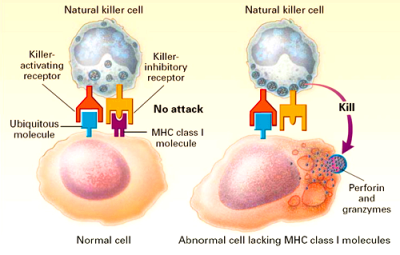
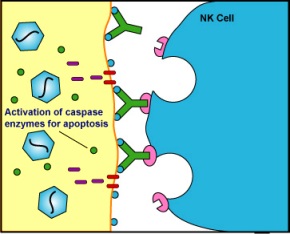
Γ1) Τα ΦΥΣΙΚΑ ΦΟΝΙΚΑ ΚΥΤΤΑΡΑ (NK cells) περιπολούν στο σώμα και αν ανιχνεύσουν κύτταρα μολυσμένα από ιούς, τα εξοντώνουν. Η εξόντωση (διάλυση του κυττάρου) γίνεται με την έκκριση ορισμένων ουσιών από τα κοκκία τους, της Perforin που τρυπά την επιφάνεια του παθογόνου και τα Granzymes που το σκοτώνουν.
[# Τα φυσικά φονικά κύτταρα εξοντώνουν όσα κύτταρα μας ΔΕΝ έχουν στην επιφάνεια τους πρωτεΐνες MHC (σύμπλεγμα μείζονος ιστοσυμβατότητας) τύπου I, λόγω της φθοράς τους από τον ιό. (Δες πιο κάτω)
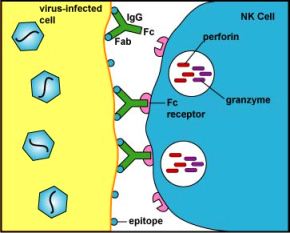
# Επίσης εξοντώνουν και όσα μολυσμένα κύτταρα έχουν στην επιφάνεια τους αντισώματα κατά του ιού που τα μόλυνε (antibody-dependent cell cytotoxicity )]
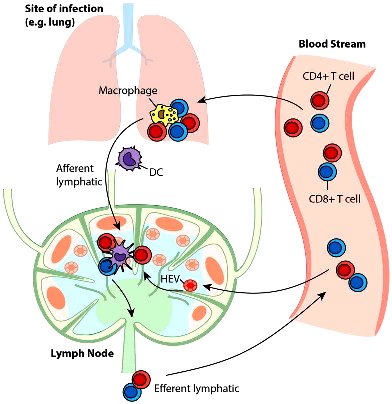
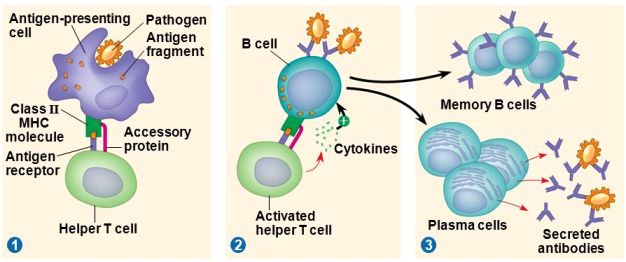
Γ2) Τα ΔΕΝΔΡΙΤΙΚΑ ΚΥΤΤΑΡΑ, που προέρχονται από τα μονοκύτταρα, βρίσκονται κάτω από το ενδοθήλιο (στο δέρμα και τους βλεννογόνους) και είναι αμυντικά κύτταρα που συνδέουν την εγγενή και την επίκτητη ανοσία.
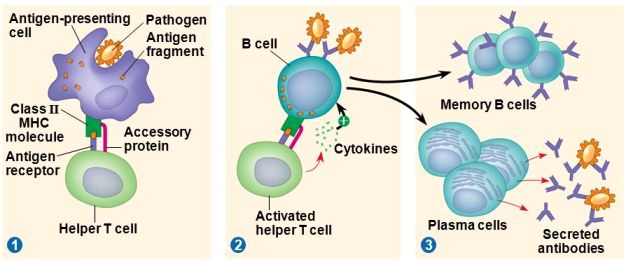
Τα δενδριτικά κύτταρα (DC) αφού καταπιούν τους ιούς, τους διασπούν και εμφανίζουν στην επιφάνεια τους κομμάτια τους (αντιγονονικά πεπτίδια των ιών ή επιτόπια).
Στη συνέχεια τα Δενδριτικά (DC) κύτταρα μπαίνουν στα λεμφαγγεία για να φτάσουν στους λεμφαδένες. Εκεί διεγείρουν το επίκτητο ανοσοποιητικό σύστημα με την ενεργοποίηση των Τ και Β λεμφοκυττάρων.
Γ3) Τα Β λεμφοκύτταρα, επίσης καταπίνουν ιούς και παρουσιάζουν πεπτίδια των ιών στην επιφάνεια τους (αντιγονοπαρουσιαστικά κύτταρα) ώστε να ενεργοποιηθούν τα Τ λεμφοκύτταρα.
Μερικά είδη Β λεμφοκυττάρων έχουν ρόλο και στην εγγενή ανοσία. Αυτά είναι τα B1 B λεμφοκύτταρα και τα Β λεμφοκύτταρα της περιθωριακής ζώνης (marginal zone).
Αυτά παράγουν “άμεσα” φυσικά αντισώματα (nAbs), χωρίς να χρειάζονται ενεργοποίηση από τα Τ βοηθητικά λεμφοκύτταρα
Η ΕΠΙΚΤΗΤΗ ΑΝΟΣΙΑ
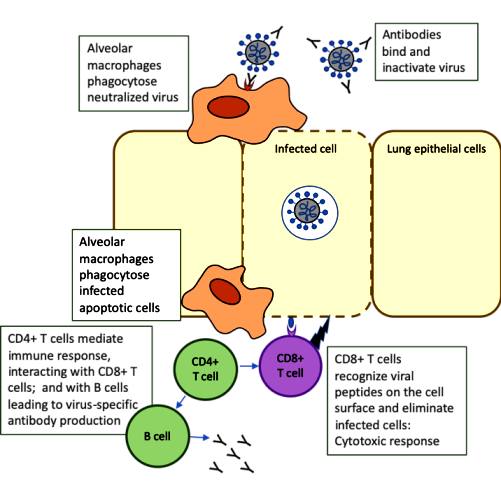
Η επίκτητη ανοσία αφορά στην ενεργοποίηση των Τ λεμφοκυττάρων (για την καταστροφή των μολυσμένων από τον ιό κυττάρων) και των Β λεμφοκυττάρων για την παραγωγή αντισωμάτων που θα εξουδετερώσουν τον ιό (λέγεται χυμική ανοσία).
ΤΑ ΕΙΔΗ ΤΩΝ ΛΕΜΦΟΚΥΤΤΑΡΩΝ
Τα λεμφοκύτταρα είναι δυο ειδών, τα Τ λεμφοκύτταρα και τα Β λεμφοκύτταρα.
## Η τεράστια ποικιλομορφία στα αντισώματα (και τους αντίστοιχους υποδοχείς των Β λεμφοκυττάρων) όπως και στους υποδοχείς των Τ λεμφοκυττάρων (TCR), δημιουργείται από κόψιμο, αναδιάταξη και ράψιμο των σχετικών γονιδίων του DNA, κατά την ωρίμανση των λεμφοκυττάρων (V(D)J recombination).
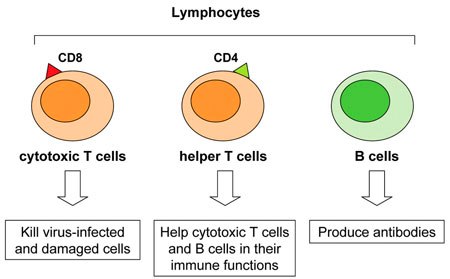
Α) Από τα Τ λεμφοκύτταρα προέρχονται δυο ειδών δραστικά κύτταρα:
i) Τα CD4+ βοηθητικά T λεμφοκύτταρα, που εκκρίνουν κυτταροκίνες ώστε να ενεργοποιηθούν τα υπόλοιπα λεμφοκύτταρα και τα μακροφάγα κύτταρα.
ii) Τα κυτταροτοξικά CD8+ Τ λεμφοκύτταρα (Cytotoxic T Lymphocytes ή CTLs) που σκοτώνουν τα μολυσμένα μας κύτταρα. (Πρόσφατα αποδείχθηκε ότι αυτά μπορούν να εξοντώσουν και εξωκυττάρια μικρόβια, παράσιτα και μύκητες)
Η ΚΑΤΑΓΩΓΗ ΤΩΝ Τ ΛΕΜΦΟΚΥΤΤΑΡΩΝ
Τα Τ Λεμφοκύτταρα παράγονται στον μυελό των οστών και διαφοροποιούνται στο θύμο αδένα.
Τα παρθένα (ανενεργά) Τ λεμφοκύτταρα (CD4 και CD8), μετακινούνται από το Θύμο αδένα (σε μικρή ηλικία) μέσω του αίματος στους λεμφικούς ιστούς (π.χ. λεμφαδένες), όπου περιμένουν μέχρι να χρειαστούν, αν ποτέ χρειαστούν. (Δες πιο κάτω)
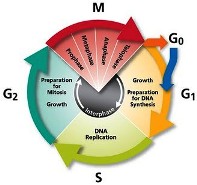
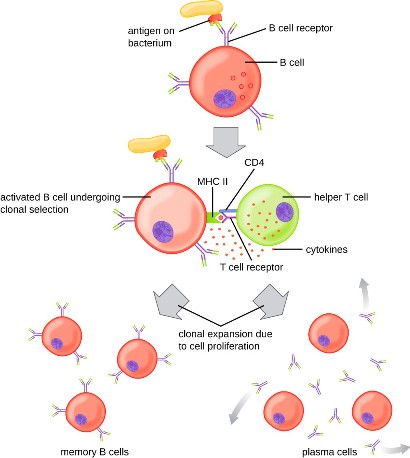
Από τα παρθένα CD4 και CD8 Τ λεμφοκύτταρα ενεργοποιούνται (ξεφεύγουν από τη φάση G “0” και μπαίνουν στον κυτταρικό κύκλο) μόνο τα ελάχιστα που θα αναγνωρίσουν το αντιγόνο του ιού που τους παρουσιάζει το Δενδριτικό κύτταρο (ή το μακροφάγο, ή το Β λεμφοκύτταρο), οπότε και μετατρέπονται στα δραστικά CD4+ και CD8+ Τ λεμφοκύτταρα.
Μόλις αυτά ενεργοποιηθούν, αναπαράγονται σε τεράστιους αριθμούς, εκατομμύρια, μέσω κλωνοποίησης.
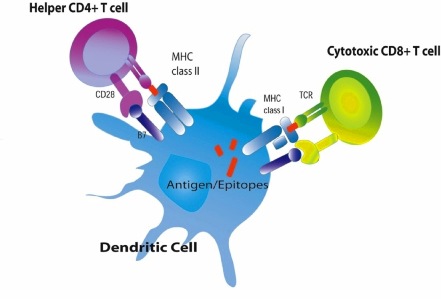
Στην πιο πάνω εικόνα φαίνεται ένα Δενδριτικό κύτταρο (δεξιά) που εφάπτεται με ένα παρθένο Τ λεμφοκύτταρο ώστε να του παρουσιάσει τμήματα πρωτεϊνών του εισβολέα, για να το ενεργοποιήσει.
Στη συνέχεια τα Τ λεμφοκύτταρα κυκλοφορούν μέχρι ο ειδικός υποδοχέας τους, TCR, να ανακαλύψει το αντίστοιχο αντιγόνο στα μολυσμένα κύτταρα μας.
Β) Τα Β Λεμφοκύτταρα παράγονται και διαφοροποιούνται στον μυελό των οστών, λέγονται “παρθένα” Β λεμφοκύτταρα και από αυτά προέρχονται τα δραστικά κύτταρα, πλασματοκύτταρα που παράγουν αντισώματα για την εξουδετέρωση των εισβολέων.
> Κάθε “παρθένο” Β λεμφοκύτταρο εκφράζει έναν υποδοχέα (B-cell receptor ή BCR), από τους αμέτρητους που υπάρχουν στον πληθυσμό των Β λεμφοκυττάρων και δημιουργήθηκαν από τυχαίο ανασυνδυασμό γονιδίων (V(D)J recombination) στον μυελό των οστών.
Τα “παρθένα” Β λεμφοκύτταρα περιπολούν και όταν ανιχνευθεί ένας μικροοργανισμός εισβολέας, ο υποδοχέας BCR αναγνωρίζει αν υπάρχει η συγκεκριμένη πρωτεΐνη (αντιγόνο) που αντιστοιχεί σ’ αυτόν.
>> Αν βρεθεί ότι υπάρχει το συγκεκριμένο αντιγόνο, στον μικροοργανισμό εισβολέα, τα “παρθένα” Β λεμφοκύτταρα διαφοροποιούνται σε πλασματοκύτταρα μικρής διάρκειας ζωής (που παράγουν IgM) και σε άλλα Β λεμφοκύτταρα που μεταλλάσεται πολλές φορές το γονίδιο του υποδοχέα τους BCR στους λεμφαδένες και τον σπλήνα μέχρι να βρεθεί ο ακριβέστερος υποδοχέας για το συγκεκριμένο αντιγόνο. (Δες πιο κάτω)
>>> Αφού βρεθεί ο ακριβέστερος υποδοχέας, τα Β λεμφοκύτταρα διαφοροποιούνται σε Β λεμφοκύτταρα μνήμης μακράς διάρκειας (παραμένουν στον σπλήνα, στους λεμφαδένες, στους βλεννογόνους που μολύνθηκαν και στο αίμα) και σε πλασματοκύτταρα μακράς διάρκειας που μεταναστεύουν στο μυελό των οστών και παράγουν αντισώματα υψηλής ειδικότητας για μήνες ή και χρόνια μετά.
Τα Β λεμφοκύτταρα μνήμης μακράς διάρκειας όταν συναντηθούν με το αντιγόνο ιού (μικροβίου κλπ) που έχει μεγάλη συγγένεια με τον υποδοχέα τους, πολλαπλασιάζονται και το εξουδετερώνουν άμεσα, μέσω παραγωγής αντισωμάτων (μέσω των δραστικών τους κυττάρων, των πλασματοκυττάρων). (Δες πιο κάτω)
https://www.nature.com/articles/s41590-022-01248-5
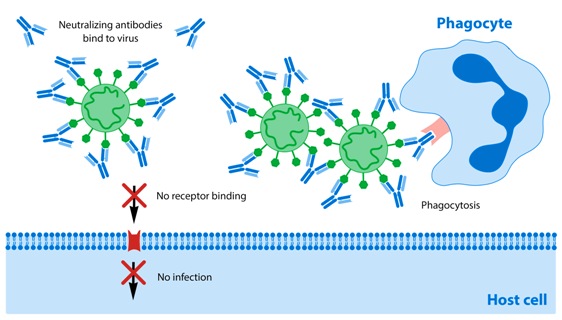
Τα αντισώματα ΕΝΩΝΟΝΤΑΙ με τους ιούς και έτσι τους εξουδετερώνουν με διάφορους τρόπους, όπως είναι η διακοπή της εισόδου του ιού στα κύτταρα, η φαγοκυττάρωση του συμπλέγματος ιού-αντισωμάτων κλπ. (Δες πιο κάτω)
ΛΕΠΤΟΜΕΡΕΙΕΣ ΓΙΑ ΤΑ ΛΕΜΦΟΚΥΤΤΑΡΑ
ΤΑ Τ ΛΕΜΦΟΚΥΤΤΑΡΑ
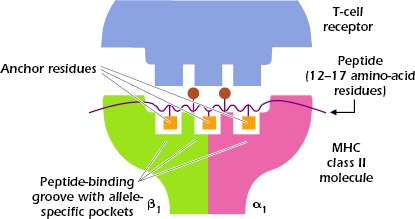
Τα Τ λεμφοκύτταρα, μέσω των εκατομμυρίων, διαφορετικών αντιγονικών υποδοχέων (TCR) που μπορεί να έχουν, αναγνωρίζουν τα αντίστοιχα αντιγονονικά πεπτίδια ή επιτόπια στην επιφάνεια των κυττάρων μας πάνω στις πρωτεΐνες MHC (σύμπλεγμα μείζονος ιστοσυμβατότητας), ΑΝ αυτά εμφανιστούν στο μέλλον (αν υπάρξει λοίμωξη).
Υπάρχουν περίπου 20 εκατομμύρια, διαφορετικά Τ λεμφοκύτταρα (παρθένα CD4 και CD8) που δημιουργούνται στο θύμο αδένα.
Στη συνέχεια τα παρθένα CD4 και CD8 μετακινούνται μέσω του αίματος στους λεμφικούς ιστούς (π.χ. λεμφαδένες), όπου περιμένουν μέχρι να χρειαστούν, αν ποτέ χρειαστούν.
Το κάθε παρθένο CD4 και CD8 Τ λεμφοκύτταρο μπορεί να έχει έναν ή και περισσότερους αντιγονικούς υποδοχείς (TCRs) από τους τουλάχιστον 100 δισεκατομμύρια (!!) μοναδικούς TCRs που δημιουργούνται με τυχαίο τρόπο στο θύμο αδένα.
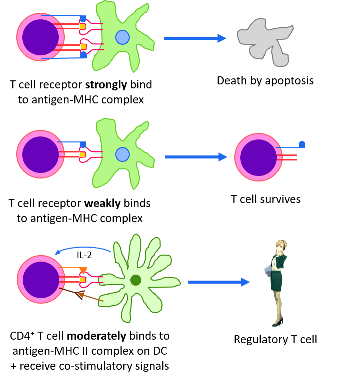
[Όμως πρέπει να διασφαλιστεί ότι τα Τ λεμφοκύτταρα δεν θα επιτίθενται στα δικά μας κύτταρα (T cell tolerance) και δεν θα προκαλούν αυτοάνοσες παθήσεις.
Αυτό γίνεται κατά την ωρίμανση τους στο θύμο αδένα (central tolerance), όπου όσα ανώριμα Τ λεμφοκύτταρα βρεθούν ότι ενώνονται ΙΣΧΥΡΑ στις πρωτεΐνες του σώματος μας που εμφανίζονται στις πρωτεΐνες MHC Ι και MHC ΙΙ** στην επιφάνεια των επιθηλιακών (mTECs), δενδριτικών κυττάρων και Β λεμφοκυττάρων του θύμου, καταστρέφονται ώστε να μην μπουν στην κυκλοφορία (negative selection).
Αν ενώνονται ασθενώς στα δικά μας μόρια MHC δημιουργούνται (positive selection) τα ώριμα κυτταροτοξικό-φονικό Τ λεμφοκύτταρο CD8+ και τα ώριμα helper Τ λεμφοκύτταρο CD4+ (ή TH cell).
Αν ενώνονται μέτρια με τα δικά μας μόρια MHC δημιουργούνται τα ρυθμιστικά Τ λεμφοκύτταρα (Regulatory T cells ή Tregs) και τα ανενεργά Τ λεμφοκύτταρα (δυσλειτουργικά ή υπολειτουργικά) anergic T cells.
Τα Tregs καταστέλλουν το ανοσοποιητικό σύστημα όταν έχει εξοντωθεί ο εισβολέας και επιπλέον βοηθούν στην πρόληψη αυτοάνοσων παθήσεων.
Δυστυχώς μερικά Τ λεμφοκύτταρα θα ξεφύγουν από τον κεντρικό έλεγχο στο θύμο αδένα, οπότε ο οργανισμός θα χρησιμοποιήσει τη δεύτερη γραμμή άμυνας (peripheral tolerance) στους λεμφαδένες και τον σπλήνα:
Αυτή γίνεται είτε με άμεση απενεργοποίηση ή θάνατο τους είτε από τα ρυθμιστικά – ανοσοκατασταλτικά λεμφοκύτταρα Tregs και Bregs (επίσης από ανασταλτικές Κυτταροκίνες, από κύτταρα της εγγενούς ανοσίας κλπ.)
[Τα Tregs είναι υποπληθυσμός των CD4+ Τ λεμφοκυττάρων που δημιουργείται στο θύμο αδένα και τα Bregs, δημιουργούνται στον μυελό των οστών και εκκρίνουν μεταξύ άλλων ανοσοκατασταλτικών ουσιών, και Ιντερλευκίνη 10 (B10 Bregs).
>> Όταν υπολειτουργούν/δυσλειτουργούν τα Tregs και τα Bregs, δεν μειώνονται τα Τ λεμφοκύτταρα (CD4+ και CD8+) και τα Β λεμφοκύτταρα αντίστοιχα, που στρέφονται εναντίον του σώματος]
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8234061/
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7140671/
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5616171/
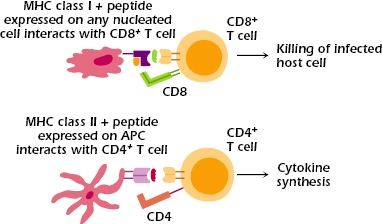
[Οι πρωτεΐνες MHC είναι απαραίτητες για να διαχωρίζει το αμυντικό μας σύστημα, ποια μόρια – αντιγόνα είναι δικά μας (αυτοαντιγόνα) και πια είναι ξένα ή αν τα κύτταρα είναι φυσιολογικά ή μολυσμένα π.χ. από ιό, βακτήριο.
Οι πρωτεΐνες MHC είναι 2 ειδών, η MHC Ι και η MHC ΙΙ. Η πρωτεΐνη MHC I βρίσκεται σε όλα τα κύτταρα μας (εκτός των ερυθροκυττάρων και των αιμοπεταλίων), και η πρωτεΐνη MHC IΙ βρίσκεται (μαζί με την MHC I) στα αντιγονοπαρουσιαστικά κύτταρα (Δενδριτικά κύτταρα, στα Μακροφάγα και στα Β λεμφοκύτταρα).
Έτσι τα αντιγονοπαρουσιαστικά κύτταρα έχουν και τους δυο τύπους MHC.]
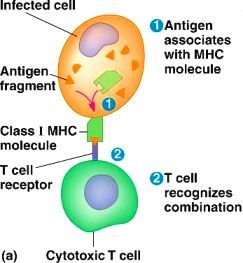
ΤΑ ΚΥΤΤΑΡΟΤΟΞΙΚΑ CD8+ Τ ΛΕΜΦΟΚΥΤΤΑΡΑ
# Αν βρεθεί το αντίστοιχο αντιγονικό πεπτίδιο του εισβολέα, σε σχέση κλειδιού-κλειδαριάς, (πάνω σε πρωτεΐνη MHC Ι) σε μολυσμένο κύτταρο (για όλα τα κύτταρα εκτός των ερυθρών και των αιμοπεταλίων), το κυτταροτοξικό CD8+ Τ λεμφοκύτταρο, ενώνεται με αυτό το κύτταρο και το εξοντώνει.
Η εξόντωση γίνεται με την έκκριση ορισμένων ουσιών από τα κοκκία τους, της Perforin που τρυπά την επιφάνεια του μολυσμένου κυττάρου και τα Granzymes που το σκοτώνουν (όπως και στα NK cells ).
Τα κυτταροτοξικά CD8+ Τ λεμφοκύτταρα, εξοντώνουν στην ουσία τους ενδοκυττάριους ιούς (επίσης ενδοκυττάρια βακτηρίδια και τα καρκινικά κύτταρα).
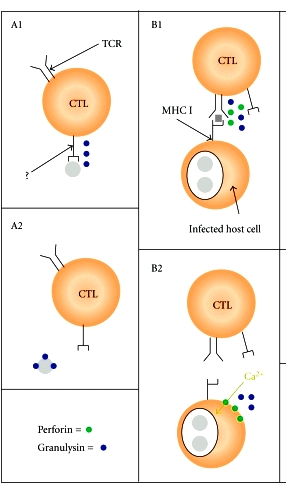
# Πρόσφατα όμως αποδείχθηκε ότι τα κυτταροτοξικά λεμφοκύτταρα (CD8+ ή CTL), μπορούν να αναγνωρίσουν εξωκυττάρια μικρόβια, παράσιτα και μύκητες (με άγνωστο υποδοχέα), να ενωθούν μαζί τους και να τα εξοντώσουν, μέσω της ουσίας Granulysin.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2896662/
Στο πιο πάνω σχεδιάγραμμα αριστερά φαίνεται η εξόντωση εξωκυττάριων μικροβίων, παρασίτων και μυκήτων (με άγνωστο υποδοχέα), μέσω της ουσίας Granulysin. (Δεξιά φαίνεται ο μέχρι τώρα γνωστός τρόπος εξόντωσης μολυσμένων κυττάρων) Τα μικρόβια παρουσιάζονται με γκρίζο χρώμα.
ΤΑ CD4+ ΒΟΗΘΗΤΙΚΑ T ΛΕΜΦΟΚΥΤΤΑΡΑ
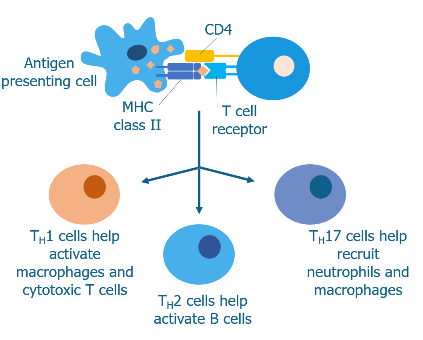
# Αν βρεθεί το αντίστοιχο αντιγονικό πεπτίδιο των εισβολέα, σε σχέση κλειδιού-κλειδαριάς, (πάνω σε πρωτεΐνη MHC ΙΙ) σε αντιγονοπαρουσιαστικό κύτταρο (δενδριτικό, μακροφάγο, Β λεμφοκύτταρο και μερικά επιθηλιακά κύτταρα), τα CD4+ βοηθητικά T λεμφοκύτταρα, ενώνονται με αυτό το αντιγονοπαρουσιαστικό κύτταρο.
Έτσι τα CD4+ βοηθητικά T λεμφοκύτταρα αρχίζουν να βοηθούν άλλα αμυντικά κύτταρα (μέσω έκκρισης κυτταροκινών), όπως τα κυτταροτοξικά CD8+ Τ λεμφοκύτταρα και τα Β λεμφοκύτταρα, οπότε διαμορφώνουν την κατάλληλη απάντηση του ανοσοποιητικού απέναντι στους εισβολείς.
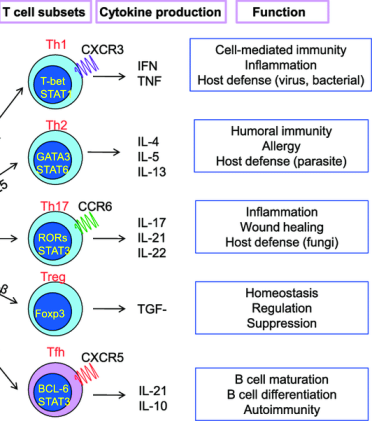
[Τα CD4+ T λεμφοκύτταρα μετατρέπονται σε διάφορα είδη Δραστικών Τ βοηθητικών λεμφοκυττάρων (τα τύπου Th1, Th2, TFH, Th17, Th9, Th22 κύτταρα κλπ.), ανάλογα με τις οδηγίες (υπό τη μορφή κυτταροκινών) που παίρνουν από κύτταρα της εγγενούς ανοσίας και κυρίως τα αντιγονοπαρουσιαστικά κύτταρα (μακροφάγα, δενδριτικά κύτταρα, Β λεμφοκύτταρα), ώστε να βοηθήσουν στην εξόντωση του εισβολέα μικροοργανισμού, με την έκκριση των ανάλογων κυτταροκινών.
>> Τα τύπου Th1 κύτταρα διαφοροποιούνται (με τη βοήθεια της IL-12) στους λεμφαδένες, ταξιδεύουν στο σημείο της φλεγμονής και βοηθούν με την έκκριση των κυτταροκινών INF γ, IL-2 και TNFα, στην ενεργοποίηση των μακροφάγων και των κυτταροτοξικών CD8+ λεμφοκυττάρων για την καταπολέμηση των ενδοκυτταρίων ιών, ορισμένων ενδοκυτταρίων μικροβίων, ενδοκυταρίων πρωτοζώων κλπ.
Επιτυγχάνουν την καταπολέμηση των ιών, βοηθώντας τα κυτταροτοξικά CD8+ Τ λεμφοκύτταρα και τα φαγοκύτταρα στην καταστροφή των μολυσμένων κυττάρων. Επιπλέον βοηθούν τα Β λεμφοκύτταρα στην παραγωγή IgG αντισωμάτων.
>> Τα τύπου Th2 κύτταρα διαφοροποιούνται από την IL-4 και:
α) Βοηθούν στην καταπολέμηση εξωκυττάριων παρασίτων (π.χ. σκωλήκων – helminths) κυρίως μέσω επιστράτευσης ηωσινοφίλων (και βασεοφίλων και μαστοκυττάρων) από την Ιντερλευκίνη 5 (IL-5 ).
β) Μέσω των IL-4 και IL-13, ενεργοποιούν τα Β Λεμφοκύτταρα στην παραγωγή αντισωμάτων (χυμική ανοσία).
# Σε υπερ-αντίδραση των Th2 κυττάρων, δημιουργείται αλλεργία.
> Τα Τh 17 λεμφοκύτταρα εκκρίνουν Ιντερλευκίνη 17 για πρόσκληση κυρίως ουδετεροφίλων, ώστε να εξοντώσουν εξωκυττάριους μύκητες και μικρόβια.]
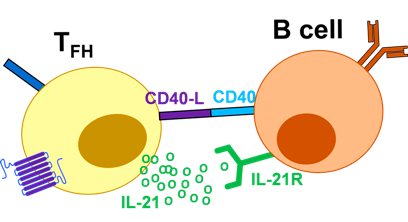
## Σε εισβολή ιών, Τα CD4+ T λεμφοκύτταρα διαφοροποιούνται σε τύπου Th1 κύτταρα, σε Th2 κύτταρα και σε Τ Λεμφοκύτταρα TFH (follicular helper T cell). Τα TFH και τα Th2 κύτταρα ενεργοποιούν τα Β λεμφοκύτταρα για την παραγωγή αντισωμάτων.
ΤΑ Β ΛΕΜΦΟΚΥΤΤΑΡΑ
Τα Β λεμφοκύτταρα, επίσης καταπίνουν ιούς και παρουσιάζουν πεπτίδια των ιών στην επιφάνεια τους (αντιγονοπαρουσιαστικά κύτταρα). Έτσι η ένωση τους με τα CD4+ βοηθητικά T λεμφοκύτταρα (ειδικότερα τα Τ Λεμφοκύτταρα TFH, που είναι ένα από τα είδη των CD4+ βοηθητικών T λεμφοκυττάρων), τα ενεργοποιεί ώστε να πολλαπλασιάζονται γρήγορα, και να μετατραπούν σε Β λεμφοκύτταρα μνήμης και σε Πλασματοκύτταρα.
Κάθε “παρθένο” Β λεμφοκύτταρο εκφράζει έναν υποδοχέα (B-cell receptor ή BCR), από τους αμέτρητους που υπάρχουν στον πληθυσμό των Β λεμφοκυττάρων και δημιουργήθηκαν από τυχαίο ανασυνδυασμό γονιδίων (V(D)J recombination) στον μυελό των οστών.
Αυτός ο υποδοχέας (BCR) αναγνωρίζει αν υπάρχει η συγκεκριμένη πρωτεΐνη (αντιγόνο) που αντιστοιχεί σ’ αυτόν, στην επιφάνεια ενός παθογόνου (ιού, μικροβίου κλπ.).
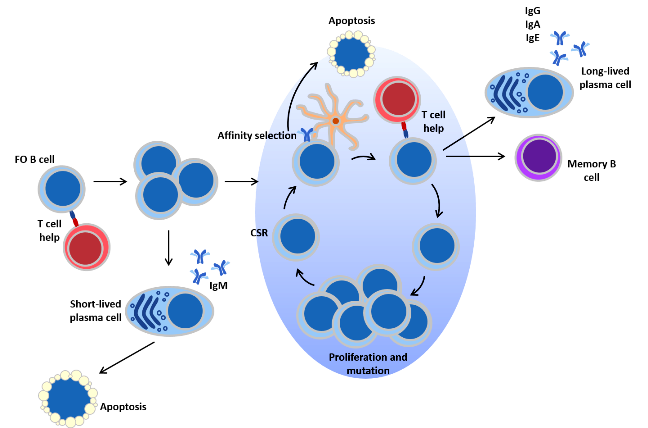
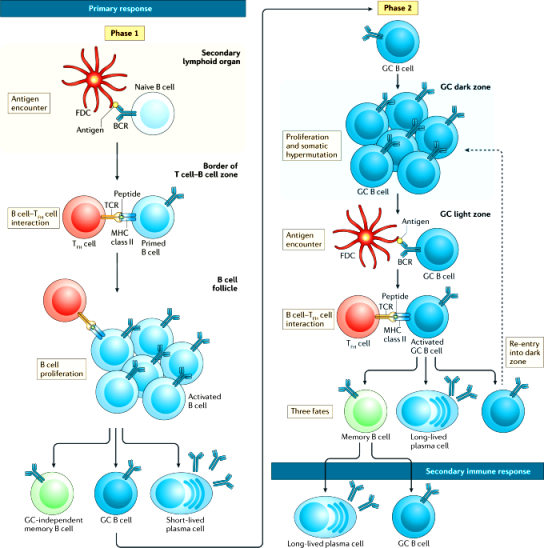
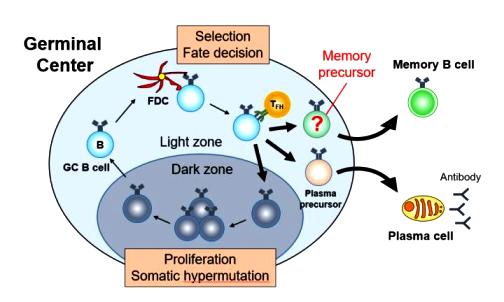
> Τα “παρθένα” Β λεμφοκύτταρα περιπολούν και όταν ανιχνευθεί να υπάρχει το συγκεκριμένο αντιγόνο, σε έναν μικροοργανισμό εισβολέα, αυτά διαφοροποιούνται σε πλασματοκύτταρα μικρής διάρκειας ζωής (που παράγουν IgM) και σε Β λεμφοκύτταρα των βλαστικών κέντρων (GC B cells) στους λεμφαδένες και τον σπλήνα.
>> Στη συνέχεια, το αντιγόνο (πρωτεΐνη) των παθογόνων οδηγεί τα Β λεμφοκύτταρα των βλαστικών κέντρων (GC B cells) να διαφοροποιηθούν (με τη βοήθεια των T follicular helper cells ή TFH cells) και να μεταλλαχθεί πολλές φορές το γονίδιο του υποδοχέα τους BCR (somatic hypermutation) μέχρι να βρεθεί ο ακριβέστερος υποδοχέας για το συγκεκριμένο αντιγόνο (affinity maturation).
[Στη διάρκεια της λοίμωξης συμβαίνει ακόμη μεγαλύτερη εξειδίκευση (affinity maturation) του υποδοχέα BCR ως προς το αντιγόνο με τυχαίες μεταλλάξεις του DNA του υποδοχέα από το ένζυμο AID.
Το ένζυμο AID (activation-induced cytidine deaminase) δημιουργεί μεταλλάξεις στο DNA αλλάζοντας τη βάση Κυτοσίνη με τη βάση Ουρακίλη)]
Το Β λεμφοκύτταρο που έχει τον ακριβέστερο υποδοχέα BCR ως προς το αντιγόνο, επικρατεί των υπολοίπων και πολλαπλασιάζεται.
>>> Αφού βρεθεί ο ακριβέστερος υποδοχέας, τα Β λεμφοκύτταρα διαφοροποιούνται (με τη βοήθεια των T follicular helper cells ή TFH cells) σε Β λεμφοκύτταρα μνήμης μακράς διάρκειας (αυτά παραμένουν στους λαμφαδένες σε φάση “0”) και σε πλασματοκύτταρα μακράς διάρκειας (Long lived plasma cells ή LLPCs) που μεταναστεύουν στο μυελό των οστών και συνεχίζουν να παράγουν αντισώματα υψηλής ειδικότητας για μήνες ή και χρόνια μετά.
Επιπλέον, Β λεμφοκύτταρα μνήμης κυκλοφορούν – περιπολούν στο αίμα και αν κάποτε συναντήσουν το ίδιο αντιγόνο που έχει μεγάλη συγγένεια με τον υποδοχέα τους, πολλαπλασιάζονται και το εξουδετερώνουν άμεσα.
[Επίσης υπάρχουν και τα Β ρυθμιστικά λεμφοκύτταρα που εκκρίνουν Ιντερλευκίνη 10 (B10 Bregs) και θεωρούνται ότι μειώνουν την υπερβολική φλεγμονή και την πιθανότητα αυτοάνοσης πάθησης]
Τα Πλασματοκύτταρα παράγουν αντισώματα και τα εξαπολύουν στο αίμα και σε άλλα σωματικά υγρά για να εξουδετερώσουν τους ιούς που έχουν τα συγκεκριμένα αντίστοιχα πεπτίδια – αντιγόνα.
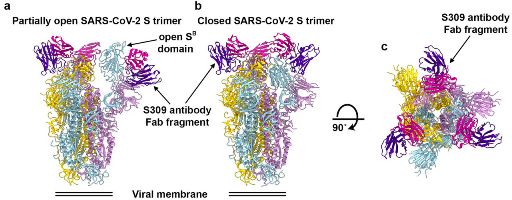
Στην ανωτέρω εικόνα, φαίνεται η ακίδα (S glycoprotein) του ιού SARS-CoV-2, με 3 αντισώματα (S309 neutralizing antibody Fab fragment) που την εξουδετερώνουν. [Το αντίσωμα S309, αναγνωρίστηκε από Β λεμφοκύτταρο μνήμης, ανθρώπου που μολύνθηκε το 2003 και επιβίωσε από τον SARS.]
https://www.nature.com/articles/s41586-020-2349-y
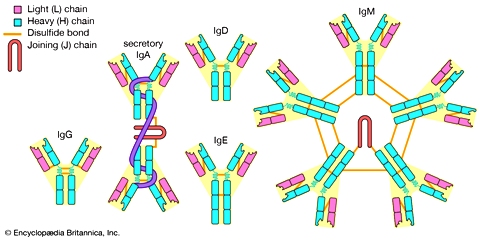
Τα αντισώματα είναι πρωτεϊνικά πολύπλοκα μόρια που παράγονται από τα πλασματοκύτταρα και είτε εκκρίνονται είτε παραμένουν ενωμένα στη μεμβράνη (IgM και IgD).
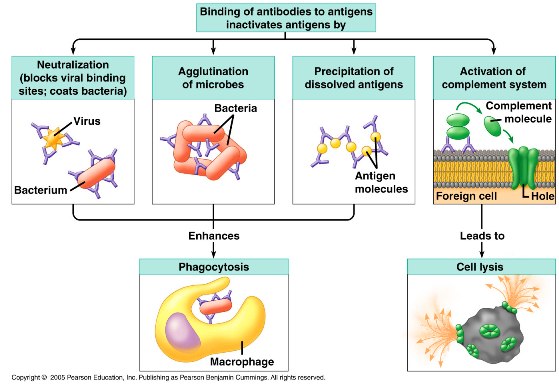
Τα αντισώματα ΕΝΩΝΟΝΤΑΙ με τους ιούς και έτσι τους εξουδετερώνουν με διάφορους τρόπους:
α) Η ένωση ενός αντισώματος με ιό εμποδίζει την είσοδο του ιού στα κύτταρα.
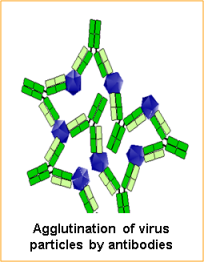
β) Αντισώματα ενώνονται με πολλούς ιούς τους “ενώνουν” (agglutination) οπότε πάλι εμποδίζεται η είσοδος τους στα κύτταρα.
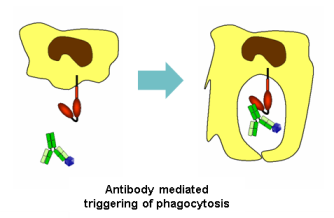
γ) Τα αντισώματα ενώνονται με τους ιούς και με τους Fc υποδοχείς στα φαγοκύτταρα, οπότε τα φαγοκύτταρα εξοντώνουν ευκολότερα τους ιούς “τρώγοντας” τους (φαγοκυττάρωση).
δ) Τα αντισώματα επιπλέον ενεργοποιούν το σύστημα του συμπληρώματος. H πρωτεΐνη C3b σαν ενδιάμεσο μόριο (οπότε λέγεται οψωνίνη) ενώνεται με τον ιό και ταυτόχρονα με φαγοκύτταρα (π.χ. μακροφάγα, ουδετερόφιλα), οπότε ακολουθεί η φαγοκυττάρωση του ιού.
Η ΜΝΗΜΗ ΣΕ ΜΕΛΛΟΝΙΚΗ ΕΙΣΒΟΛΗ ΤΟΥ ΙΔΙΟΥ ΜΙΚΡΟΟΡΓΑΝΙΣΜΟΥ
Σε άλλο άρθρο αναφέρεται ειδικότερα η ΑΝΟΣΟΛΟΓΙΚΗ ΜΝΗΜΗ σε επόμενη εισβολή του κορωνοϊού SARS-CoV-2.
Το ανοσοποιητικό μας σύστημα, πέρα από την εξόντωση των εισβολέων μικροοργανισμών, έχει και μια άλλη πολύ σπουδαία αποστολή, να θυμάται τους προηγούμενους εισβολείς και να ανταποκρίνεται άμεσα και ισχυρά για να τους εξοντώσει αν υπάρξει νέα “επίθεση” από τον ίδιο εισβολέα.
Μέσω της κλωνοποίησης παράγονται δυο ειδών κύτταρα, τα ΔΡΑΣΤΙΚΑ κύτταρα (Effector cells) που θα εξοντώσουν τους ιούς, και τα κύτταρα ΜΝΗΜΗΣ (Τ και Β λεμφοκύτταρα μνήμης) που θα παραμείνουν σε ετοιμότητα ώστε να εξοντώσουν τον ίδιο εισβολέα (αν δεν υπάρχει σημαντική μετάλλαξη του), αν υπάρξει νέα “επίθεση” από αυτόν στο μέλλον.
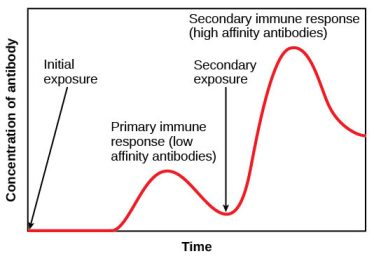
Η απάντηση του ανοσοποιητικού μας συστήματος σε επόμενη εισβολή του ίδιου μικροοργανισμού, είναι πολύ γρηγορότερη, ισχυρότερη και πιο εξειδικευμένη, συγκριτικά με την πρώτη εισβολή.
Το ότι τα αντισώματα μειώνονται σε λίγο καιρό δεν έχει καμιά σημασία, μειώνονται γιατί εκτέλεσαν την αποστολή τους, την εξόντωση του εισβολέα, και δεν χρειάζεται να συνεχίσει η παραγωγή τους από τα πλασματοκύτταρα.
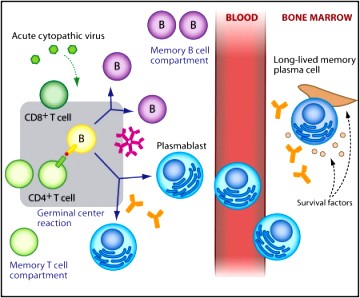
Στην πρώτη εισβολή ενός παθογόνου, τα “παρθένα” (naïve) Λεμφοκύτταρα Τ και Β, διαφοροποιούνται στα αντίστοιχα δραστικά κύτταρα για την εξόντωση του εισβολέα και στα Λεμφοκύτταρα μνήμης Τ και Β.
Τα Λεμφοκύτταρα μνήμης Τ και Β, δεν συμμετέχουν κατά την πρώτη εισβολή στην εξουδετέρωση του εισβολέα, παραμένουν κυρίως στον σπλήνα και στους λεμφαδένες, και καιροφυλακτούν για την περίπτωση που μετά από μήνες, χρόνια ή και 10ετίες, ξανα-εισβάλει ακριβώς το ίδιο αντιγόνο (ο ίδιος ιός, το ίδιο μικρόβιο κλπ).
Όσο περιμένουν τα Λεμφοκύτταρα μνήμης Τ και Β αυτo-ανανεώνονται, για να μην εκλείψουν μετά από ορισμένο χρόνο.
Αν ξαναγίνει δεύτερη εισβολή από το ίδιο αντιγόνο (παθογόνο) αυτά ενεργοποιούνται, πολλαπλασιάζονται (κλωνοποίηση) και μετατρέπονται άμεσα τα μεν Λεμφοκύτταρα Τ μνήμης στα κυτταροτοξικά CD8+ Τ λεμφοκύτταρα και CD4+ βοηθητικά T λεμφοκύτταρα τα δε Β Λεμφοκύτταρα μνήμης (Bmem cells) σε πλασματοκύτταρα που παράγουν τα αντισώματα.
Αυτή η αντίδραση – απάντηση του ανοσοποιητικού μας συστήματος, συμβαίνει τόσο γρήγορα, που πολλές φορές δεν γίνεται αντιληπτή η λοίμωξη.
ΛΕΠΤΟΜΕΡΕΙΕΣ ΓΙΑ ΤΑ Β ΛΕΜΦΟΚΥΤΤΑΡΑ ΜΝΗΜΗΣ ΚΑΙ ΤΗ ΧΥΜΙΚΗ ΑΝΟΣΙΑ
> Στην αρχή της εισβολής ενός παθογόνου τα παρθένα Β λεμφοκύτταρα διαφοροποιούνται σε πλασματοκύτταρα μικρής διάρκειας ζωής (που παράγουν IgM) και σε Β λεμφοκύτταρα των βλαστικών κέντρων (GC B cells) στους λεμφαδένες και τον σπλήνα.
>> Στη συνέχεια, οι πρωτεΐνες των παθογόνων (τα αντιγόνα) οδηγούν τα Β λεμφοκύτταρα των βλαστικών κέντρων (GC B cells) να διαφοροποιηθούν (με τη βοήθεια των T follicular helper cells ή TFH cells) σε Β λεμφοκύτταρα μνήμης μακράς διάρκειας και σε πλασματοκύτταρα μακράς διάρκειας (Long lived plasma cells ή LLPCs) που μεταναστεύουν στο μυελό των οστών και συνεχίζουν να παράγουν αντισώματα υψηλής ειδικότητας για μήνες ή και χρόνια μετά.
Τα Β λεμφοκύτταρα μνήμης μακράς διάρκειας παραμένουν στους λεμφαδένες, τον σπλήνα και στους ιστούς που μολύνθηκαν σε φάση αναμονής, “0”, του κυτταρικού κύκλου.
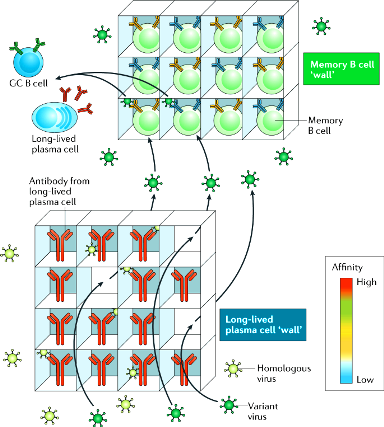
>>> Αν υπάρξει δεύτερη εισβολή του ίδιου παθογόνου τα πλασματοκύτταρα μακράς διάρκειας που μετανάστευσαν στο μυελό των οστών αποτελούν την 1η γραμμή άμυνας, με τη συνεχή παραγωγή αντισωμάτων για χρόνια.
[Υπ’ όψιν ότι έχουν βρεθεί σε μυελό των οστών ειδικά πλασματοκύτταρα μακράς διάρκειας μετά από εμβολιασμό, περισσότερα από 35 χρόνια μετά την εξάλειψη της ευλογιάς.
https://www.frontiersin.org/articles/10.3389/fimmu.2019.01787/full]
>>> Σε μια δεύτερη εισβολή ίδιου ή παρεμφερούς ιού (variant virus), τα Β κύτταρα μνήμης μακράς διάρκειας που παρέμειναν στους λεμφαδένες, τον σπλήνα και στους ιστούς που μολύνθηκαν, ξαναμπαίνουν στον κυτταρικό κύκλο (στη φάση G1) και δημιουργούν τη 2η γραμμή άμυνας.
Επιπλέον, Β λεμφοκύτταρα μνήμης κυκλοφορούν – περιπολούν στο αίμα και αν κάποτε συναντήσουν το ίδιο αντιγόνο που έχει μεγάλη συγγένεια με τον υποδοχέα τους, πολλαπλασιάζονται και το εξουδετερώνουν άμεσα.
[Επιπλέον, ανοσολογική μνήμη διαθέτουν και τα φυσικά φονικά κύτταρα (NK cells)]
Η προστασία σχεδόν όλων των εμβολίων βασίζεται στην ικανότητα τους να δημιουργούν μνήμη στα Β λεμφοκύτταρα, δηλαδή να δημιουργούν Β λεμφοκύτταρα μνήμης και πλασματοκύτταρα μακράς διάρκειας.
https://www.nature.com/articles/s41577-019-0244-2
ΤΑ ΠΛΑΣΜΑΤΟΚΥΤΤΑΡΑ ΜΑΚΡΑΣ ΔΙΑΡΚΕΙΑΣ ΖΩΗΣ (LLPC)
Τα αντισώματα παράγονται για μεγάλα χρονικά διαστήματα, από τα πλασματοκύτταρα μακράς διάρκειας ζωής, μετά από ΜΙΑ ΜΟΝΟ έκθεση σε αντιγόνα ιών ή εμβολίων.
Βρέθηκε ότι ο χρόνος ημίσειας ζωής των αντισωμάτων ήταν: 11 χρόνια για τον Τέτανο, 19 χρόνια για την Διφθερίτιδα, πάνω από 25 χρόνια για την Ηπατίτιδα Α , 50 χρόνια για την Ανεμοβλογιά, εφ’ όρου ζωής για την Ιλαρά και Παρωτίτιδα.
Η διάρκεια της παραγωγής των αντισωμάτων, εξαρτάται από τον αριθμό και τη μακροβιότητα των πλασματοκυττάρων μακράς διάρκειας ζωής.
Τα πλασματοκύτταρα μακράς διάρκειας ζωής (LLPC) είναι τελικώς διαφοροποιημένα κύτταρα που μεταναστεύουν στον μυελό των οστών και τον λεμφικό ιστό του εντέρου (GALT) και εκκρίνουν συνεχώς αντισώματα για χρόνια, χωρίς να χρειάζεται ξαναδιέγερση τους από το αντιγόνο.
(Όσα LLPC είναι στο μυελό των οστών παράγουν κυρίως αντισώματα IgG και όσα είναι στο έντερο παράγουν κυρίως αντισώματα IgA)
Η μακροβιότητα των LLPC εξαρτάται τόσο από τα γονίδια τους όσο και από άλλους παράγοντες.
Οι άλλοι παράγοντες είναι η βοήθεια από άλλα κύτταρα (π.χ. Δενδρικά, Μεγακαρυοκύτταρα, Βασεόφιλα, Ηωσινόφιλα κλπ.) που συνυπάρχουν στις ίδιες “φωλιές” (niches) επιβίωσης του μυελού των οστών, το είδος του παθογόνου και του Β λεμφοκυττάρου που τα δημιούργησε κλπ.
https://www.frontiersin.org/articles/10.3389/fimmu.2019.00965/full
https://www.frontiersin.org/articles/10.3389/fimmu.2019.01831/full
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7165522/
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3291529/#:~:text
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7398916/#CR12
https://www.nejm.org/doi/full/10.1056/NEJMoa066092
https://www.frontiersin.org/articles/10.3389/fimmu.2019.00508/full
https://www.nejm.org/doi/full/10.1056/NEJMe2028079
ΤΑ ΕΜΒΟΛΙΑ
Στόχος ενός εμβολιασμού είναι η προστασία του εμβολιαζομένου ανθρώπου και επίσης η προστασία του συνόλου του πληθυσμού, με τη διακοπή (ή μεγάλη μείωση) της μετάδοσης του μικροοργανισμού στους ανθρώπους (ανοσία της κοινότητας).
Η προστασία του εμβολιαζομένου αν μολυνθεί από τον συγκεκριμένο μικροοργανισμό κυμαίνεται από 50% (π.χ. γρίπη) ως >90% (π.χ. εμβόλια mRNA), ανάλογα με το εμβόλιο.
Για να διακοπεί η μετάδοση του μικροοργανισμού στον πληθυσμό, συνήθως πρέπει να εμβολιαστεί πάνω από το 70% των κατοίκων, ανάλογα και με την προστασία που προσφέρει το εμβόλιο, και τη μεταδοτικότητα της νόσου.
Τα εμβόλια περιέχουν είτε αντιγόνα του μικροοργανισμού (σε μορφή εξασθενημένου μικροοργανισμού ή σε μορφή τμημάτων του μικροοργανισμού) είτε οδηγίες για την παραγωγή αντιγόνων του μικροοργανισμού από τα ανθρώπινα κύτταρα.
Αυτή τη στιγμή υπάρχουν δυο τύποι εμβολίων κατά του Sars-Cov-2 που χρησιμοποιούν οδηγίες για την παραγωγή αντιγόνου από τα ανθρώπινα κύτταρα (συγκεκριμένα παραγωγή της spike πρωτεΐνης του ιού που χρειάζεται για διείσδυση στα κύτταρα μας).
Και οι δυο τύποι εμβολίου διεγείρουν τα Τ και τα Β λεμφοκύτταρα για την παραγωγή αντισωμάτων από τα Β λεμφοκύτταρα, κατά της spike πρωτεΐνης του ιού.
Το ένα είδος χρησιμοποιεί το mRNA για την παραγωγή από τα κύτταρα μας της spike πρωτεΐνης (εμβόλιο Pfizer-BioNTech, εμβόλιο MODERNA) και προκαλεί αντίδραση του ανοσοποιητικού κατά της spike πρωτεΐνης.
Το άλλο χρησιμοποιεί Αδενοϊό που μεταφέρει το τμήμα του RNA του ιού που παράγει τη spike πρωτεΐνη αγκίστρωσης του SARS-CoV-2, για την παραγωγή από τα κύτταρα μας αυτής της πρωτεΐνης και να προκληθεί αντίδραση του ανοσοποιητικού εναντίον της (εμβόλιο AstraZeneca, το Ρωσικό εμβόλιο Sputnik V κλπ.)
[Το ανοσοποιητικό μας σύστημα, πέρα από την εξόντωση των εισβολέων μικροοργανισμών, έχει και μια άλλη πολύ σπουδαία αποστολή, να θυμάται τους προηγούμενους εισβολείς και να ανταποκρίνεται άμεσα και ισχυρά για να τους εξοντώσει αν υπάρξει νέα “επίθεση” από τον ίδιο εισβολέα.
Όταν γίνει ο εμβολιασμός ή όταν υπάρξει μόλυνση από ιό, παράγονται δυο ειδών κύτταρα, τα ΔΡΑΣΤΙΚΑ κύτταρα (Effector cells) που θα εξοντώσουν τους ιούς, και τα κύτταρα ΜΝΗΜΗΣ (Τ και Β λεμφοκύτταρα μνήμης) που θα παραμείνουν σε ετοιμότητα ώστε να εξοντώσουν τον ίδιο εισβολέα (αν δεν υπάρχει σημαντική μετάλλαξη του), αν υπάρξει νέα “επίθεση” από αυτόν στο μέλλον.]
Έτσι στην ουσία πέρα από την ενεργοποίηση των Τ λεμφοκυττάρων και των Β λεμφοκυττάρων για την παραγωγή αντισωμάτων (από τα τελευταία) κατά της spike πρωτεΐνης του ιού, δημιουργούνται και κύτταρα ΜΝΗΜΗΣ (Τ και Β λεμφοκύτταρα μνήμης) που θα παραμείνουν σε ετοιμότητα ώστε να εξουδετερώσουν τη spike πρωτεΐνη του ιού, αν υπάρξει μόλυνση από τον ιό στο μέλλον και νοουμένου ότι δεν θα υπάρχει σημαντική μετάλλαξη του.
ΕΝΔΕΙΚΤΙΚΗ ΒΙΒΛΙΟΓΡΑΦΙΑ
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7185345/
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5472698/
https://www.frontiersin.org/articles/10.3389/fimmu.2020.01450/full
https://www.frontiersin.org/articles/10.3389/fimmu.2019.01787/full
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6102609/
https://www.sciencedirect.com/science/article/pii/S1876034120305670
https://www.frontiersin.org/articles/10.3389/fimmu.2019.00249/full
https://www.cell.com/cell-host-microbe/pdfExtended/S1931-3128(19)30112-X