Ο ΚΑΡΚΙΝΟΣ ΤΟΥ ΠΡΟΣΤΑΤΗ
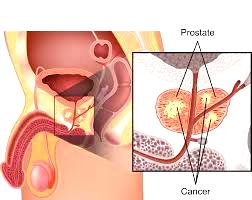
O καρκίνος του προστάτη (Ρca) χαρακτηρίζεται από αχρείαστο πολλαπλασιασμό παθολογικών κυττάρων που μπορεί να εξαπλωθούν και να καταστρέψουν γειτονικούς και απομακρυσμένους φυσιολογικούς ιστούς. Αυτός αποτελεί το 15% των συνολικών καρκίνων στον άντρα.
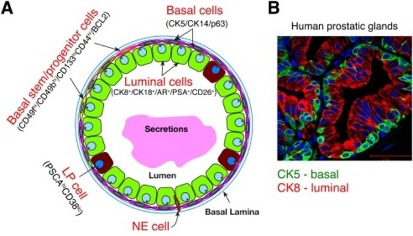
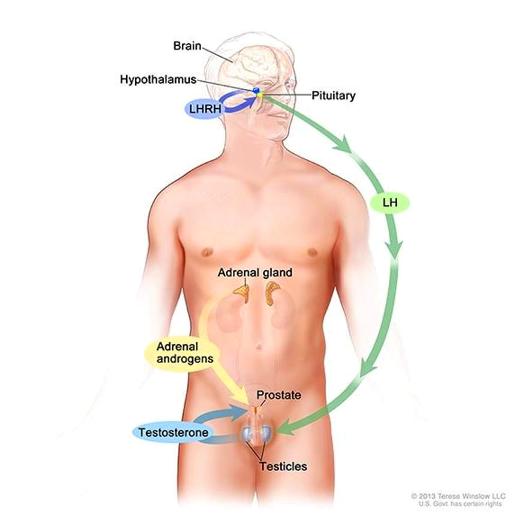
[Ο προστάτης είναι αδένας που παράγει το σπερματικό υγρό το οποίο απελευθερώνεται κατά την εκσπερμάτωση. Αυτό αναμιγνύεται με το σπέρμα ώστε να το διατηρήσει λεπτόρρευστο και να το κάνει αλκαλικό ώστε τα σπερματοζωάρια να διατηρηθούν υγιή και κινητικά επαρκή στο όξινο περιβάλλον του κόλπου.
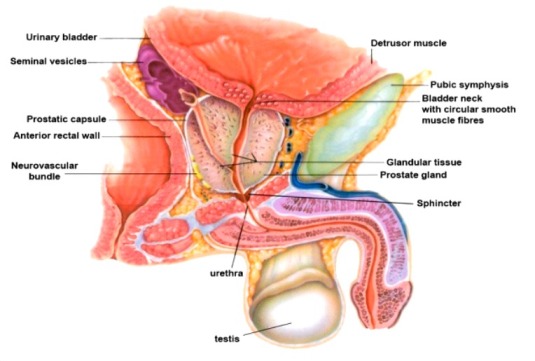
Είναι μέρος του αναπαραγωγικού συστήματος του άντρα, έχει μέγεθος καρυδιού, είναι κάτω από την ουροδόχο κύστη και περιβάλλει την ουρήθρα στο αρχικό της μέρος.]
>> Ευτυχώς όμως στις περισσότερες περιπτώσεις ο πολλαπλασιασμός των παθολογικών κυττάρων είναι αργός στον καρκίνο του προστάτη με αποτέλεσμα αυτός να μην είναι επιθετικός, να μην γίνεται κλινικά αντιληπτός από τον ασθενή και να προκαλεί μικρή μόνο μείωση του προσδόκιμου επιβίωσης του ασθενούς. (Δες πιο κάτω)
[Το πρώτο καρκινικό κύτταρο του προστάτη χρειάζεται περισσότερα από 30 χρόνια (!) για να δημιουργήσει όγκο περίπου 1 κυβικού εκατοστού.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4086477/]
>> Περισσότεροι άντρες πεθαίνουν έχοντας καρκίνο του προστάτη, παρά από αυτόν.
Η θνητότητα από τον καρκίνο του προστάτη είναι πολύ μικρότερη συγκριτικά με την επίπτωση του ανά έτος. (Στη νότια Ευρώπη είναι περίπου 6.5 φορές μικρότερη)
https://acsjournals.onlinelibrary.wiley.com/doi/10.3322/caac.21262
ΟΙ ΠΡΟΛΗΠΤΙΚΕΣ ΕΞΕΤΑΣΕΙΣ ΓΙΑ ΕΥΡΕΣΗ ΚΑΡΚΙΝΟΥ ΣΤΟΝ ΠΡΟΣΤΑΤΗ
>> Ο προληπτικός έλεγχος για καρκίνο στον προστάτη σε ασυμπτωματικό άντρα ξεκινά με την εύρεση αυξημένου PSA > 3 ng/ml σε αιματολογικό έλεγχο και ακολουθεί έλεγχος με δακτυλική εξέταση του προστάτη (DRE).
[Δες το άρθρο, το PSA, πατώντας ΕΔΩ]
[Στο μέλλον ίσως χρησιμοποιούνται και πολυγονιδικά άθροισματα κινδύνου (PRS) για την εύρεση καρκίνου του προστάτη στον γενικό πληθυσμό, π.χ. Μελέτη BARCODE 1
https://ascopubs.org/doi/pdfdirect/10.1200/JCO.2024.42.16_suppl.10500]
>> Αν η δακτυλική εξέταση του προστάτη είναι φυσιολογική και η τιμή του PSA είναι μεταξύ 3 και 10 ng/ml διενεργείται πολυπαραμετρική μαγνητική τομογραφία του προστάτη (mpMRI) [ή/και χρησιμοποιείται υπολογιστής κινδύνου (δες πιο κάτω)] για να αποφασιστεί αν θα διενεργηθεί βιοψία.
[Αν βρεθεί στην πολυπαραμετρική μαγνητική τομογραφία του προστάτη αλλοίωση PI-RADS 4-5, χρειάζεται βιοψία άσχετα από την τιμή του PSA-D (πυκνότητα PSA – Δες πιο κάτω).
Σε PI-RADS 3 και PSA-D < 0.09 ng/mL/cc, ΔΕΝ χρειάζεται βιοψία. (Δες πιο κάτω)]
>> Πάντως σύμφωνα με την Ευρωπαϊκή Ουρολογική Εταιρία (EAU – οδηγίες 2023), όσοι είναι ασυμπτωματικοί και έχουν προσδόκιμο επιβίωσης μικρότερο από 15 χρόνια, είναι αμφίβολο ότι θα ωφεληθούν από την έγκαιρη ανίχνευση του καρκίνου του προστάτη με προληπτικό έλεγχο !!
Η ΕΠΙΚΙΝΔΥΝΟΤΗΤΑ ΤΟΥ ΚΑΡΚΙΝΟΥ ΤΟΥ ΠΡΟΣΤΑΤΗ
Ο εντοπισμένος καρκίνος του προστάτη για λόγους πρόγνωσης και θεραπείας κατατάσσεται (βάσει του κλινικού σταδίου, της τιμής του PSA και του Gleason score) σε χαμηλού κινδύνου, μέτριου κινδύνου και υψηλού κινδύνου. (Δες πιο κάτω)
Ο μετρίου κινδύνου υποδιαιρείται σε ευνοϊκό (Gleason score 3+4 ή ISUP 2) και σε ΜΗ ευνοϊκό (Gleason score 4+3 ή ISUP 3). (Δες πιο κάτω)
Η μακροχρόνια πρόγνωση του καρκίνου του προστάτη είναι άριστη αν κατά τη διάγνωση αυτός περιορίζεται μόνο μέσα στον προστάτη (είναι εντοπισμένος) και δεν υπάγεται στην κατηγορία υψηλού και μη ευνοϊκού μέτριου κινδύνου. (Δες πιο κάτω)
Ειδικότερα σε εντοπισμένο καρκίνο του προστάτη, ο χαμηλού κινδύνου αποτελεί το 29.7% των περιπτώσεων και η 10ετής θνητότητα από αυτόν είναι 1.6%, ο μετρίου (ενδιαμέσου) κινδύνου αποτελεί το 48% των περιπτώσεων και η 10ετής θνητότητα από αυτόν είναι 4% και ο υψηλού κινδύνου αποτελεί το 22.3% των περιπτώσεων και η 10ετής θνητότητα από αυτόν είναι 16.8%.
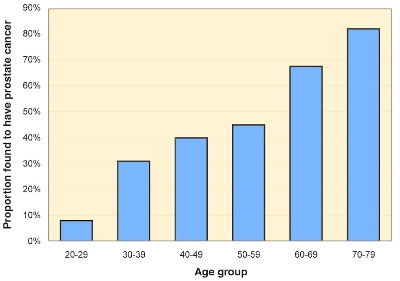
>> Οι άντρες κάτω των 40 ετών σπάνια εμφανίζουν καρκίνο του προστάτη. Όσο μεγαλώνει ένας άντρας, τόσο αυξάνεται η πιθανότητα του να εμφανίσει καρκίνο του προστάτη.
> Επιδημιολογικά και νεκροτομικά ευρήματα δείχνουν ότι ο ασυμπτωματικός εντοπισμένος καρκίνος του προστάτη χαμηλού κινδύνου και μικρό ποσοστό των άλλων μορφών του, παραμένουν αδιάγνωστα στη διάρκεια της ζωής του άντρα.
> Ειδικότερα, από νεκροτομικά ευρήματα ανδρών που απεβίωσαν από άλλες παθήσεις, καρκίνος του προστάτη εντοπίζεται στους μισούς περίπου σε ηλικίες άνω των 65 ετών, ενώ στην ηλικία των 80 ετών αυτός βρίσκεται σε ποσοστό περίπου 60%.
[Σύμφωνα με την Ευρωπαϊκή Ουρολογική Εταιρία (EAU, οδηγίες 2023) νεκροτομικά ευρήματα δείχνουν ότι, στις ηλικίες <30 ετών αυτός παρατηρείται στο 5%, ενώ σε ηλικίες >79 ετών αυτός παρατηρείται στο 48-71%.]
Υψηλού βαθμού προστατική ενδοεπιθηλιακή νεοπλασία (πρόδρομη του καρκίνου) σε νεκροτομές αναλόγως της ηλικίας.
https://pubmed.ncbi.nlm.nih.gov/8875194/
https://www.sciencedirect.com/science/article/pii/S2468294220300605
Ο κίνδυνος επέκτασης του εντοπισμένου καρκίνου του προστάτη, δηλαδή η επιθετικότητα του, εξακριβώνονται κυρίως από την τιμή του PSA, το ιστολογικό αποτέλεσμα μετά από τη βιοψία του και το κλινικό του στάδιο. (Δες πιο κάτω)
Όσο λιγότερο φυσιολογικά (πιο παραμορφωμένα) είναι τα κύτταρα του καρκίνου στην ιστολογική εξέταση τόσο πιθανότερο είναι να δημιουργηθεί μετάσταση του.
[Ο βαθμός της παραμόρφωσης των κυττάρων και της αρχιτεκτονικής διάταξης, εκφράζεται με το Gleason score.
Με Gleason score κάτω από 7 ο καρκίνος θεωρείται μη επιθετικός, με πάνω από 7 θεωρείται επιθετικός (υψηλού κινδύνου) και με τιμή 7 είναι μέτριας επιθετικότητας. (Δες πιο κάτω)]
>> Η θεραπεία του ωφελεί κυρίως όσους έχουν εντοπισμένο καρκίνο του προστάτη υψηλού κινδύνου και όσους έχουν μη ευνοϊκό μετρίου κινδύνου καρκίνο (νόσος ISUP 3), αν πρόκειται να ζήσουν περισσότερο από 10 χρόνια. (Δες πιο κάτω)
Η ΘΕΡΑΠΕΙΑ είναι η χειρουργική προστατεκτομή ή η ακτινοθεραπεία (εξωτερική ή/και εσωτερική), και σε αρκετές περιπτώσεις και η χορήγηση αντι-ανδρογόνων. (Δες πιο κάτω)
[Η λαπαροσκοπική, με ρομποτικό βραχίονα, ριζική προστατεκτομή διενεργείται σε κέντρο με όγκο 150 τουλάχιστον επεμβάσεων το χρόνο]
Οι τελευταίες οδηγίες (2023) της Ευρωπαϊκής Ουρολογικής Εταιρίας αναφέρουν: Σε εντοπισμένο κλινικά καρκίνο χαμηλού και μετρίου κινδύνου όποια από τις 2 θεραπείες και αν εφαρμοστεί ή ακόμη και αν αναβληθεί η θεραπεία, δεν διαφέρει η θνητότητα από τον καρκίνο του προστάτη, ούτε η θνητότητα από όλες τις αιτίες.
>> Όσοι ασυμπτωματικοί έχουν προσδόκιμο ζωής λιγότερο από 10 χρόνια, ασχέτως σταδίου, λαμβάνουν μόνο παρηγορητική θεραπεία όταν χρειαστεί, για να αποφευχθούν τοξικές παρενέργειες από τη θεραπεία. Η πρακτική αυτή ονομάζεται Προσεκτική Αναμονή.
ΧΑΜΗΛΟΥ ΚΙΝΔΥΝΟΥ ΚΑΡΚΙΝΟΣ: Σχεδόν όλοι χρειάζονται μόνο ενεργή παρακολούθηση, εφ’ όσον το προσδόκιμο επιβίωσης είναι μεγαλύτερο από 10 χρόνια, ώστε αν αυξηθεί η επιθετικότητα του καρκίνου, να ξεκινήσει η θεραπεία του.
[Η ενεργή παρακολούθηση περιλαμβάνει ελέγχους του PSA τουλάχιστον ανά 6μηνο, δακτυλική εξέταση, πολυπαραμετρική μαγνητική τομογραφία του προστάτη (mpMRI) σε διπλασιασμό του PSA σε λιγότερο από 3 χρόνια (PSA-DT) και βιοψίες (κάθε 2-3 χρόνια) μέχρι το προσδόκιμο ζωής του ασθενή να μειωθεί στα λιγότερα από 10 χρόνια ζωής.
Αν η mpMRI δείξει επιδείνωση διενεργείται άμεση βιοψία. Μόνο μετά από βιοψία μπορεί να αρχίσει ή να αλλάξει η θεραπεία]
ΜΕΤΡΙΟΥ ΚΙΝΔΥΝΟΥ ΕΥΝΟΙΚΟΣ ΚΑΡΚΙΝΟΣ: Η θεραπευτική επιλογή περιέχει την ενεργή παρακολούθηση (αν το ποσοστό με Gleason score 4 είναι μικρό, < 10%) ή τη ριζική προστατεκτομή ή ακτινοθεραπείες, με ή χωρίς χορήγηση αντι-ανδρογόνων (ADΤ) για 4 ως 6 μήνες. (Δες πιο κάτω)
[Η χορήγηση των αντι-ανδρογόνων (ADΤ) γίνεται πριν ή ταυτόχρονα ή μετά τις
ακτινοθεραπείες]
ΜΕΤΡΙΟΥ ΚΙΝΔΥΝΟΥ ΜΗ ΕΥΝΟΙΚΟΣ ΚΑΡΚΙΝΟΣ: Η θεραπευτική επιλογή περιέχει μόνο τη ριζική προστατεκτομή ή τις ακτινοθεραπείες, και την ταυτόχρονη χορήγηση αντι-ανδρογόνων (ADΤ) για 4 ως 6 μήνες. (Δες πιο κάτω)
ΥΨΗΛΟΥ ΚΙΝΔΥΝΟΥ ΚΑΡΚΙΝΟΣ: Η θεραπευτική επιλογή είναι ριζική προστατεκτομή ή ακτινοθεραπείες με ταυτόχρονη χορήγηση αντι-ανδρογόνων (ADΤ) για 2-3 χρόνια. (Δες πιο κάτω)
Δυστυχώς πολλές φορές οι μη επιθετικοί καρκίνοι ΥΠΕΡ-θεραπεύονται με αποτέλεσμα να έχουμε παρενέργειες από τη θεραπεία χωρίς να υπάρχει όφελος στη συνολική επιβίωση του ασθενούς.
* Rule of thumb: Life expectancy 10 years. ** Recommendation based on clinical staging using digital rectal examination, ΝΟΤ imaging. *** Recommendation based on staging using combination of bone scan and CT
Το πιο πάνω σχεδιάγραμμα δείχνει τις οδηγίες της Ευρωπαϊκής Ουρολογικής Εταιρίας (2023).
>> Ο ορισμός του καρκίνου σαν σημαντικού ή ΜΗ σημαντικού εξαρτάται από τα χαρακτηριστικά του καρκίνου και το προσδόκιμο επιβίωσης του ασθενούς.
>> Όσοι έχουν υπόλοιπο ζωής λιγότερο από 10 χρόνια και εντοπισμένο καρκίνο του προστάτη, ασχέτως σταδίου, είναι δύσκολο να έχουν όφελος στην επιβίωση από τον συγκεκριμένο καρκίνο (cancer-specific survival) με τη ριζική θεραπεία (εγχείρηση ή ακτινοθεραπεία). (Ευρωπαϊκή Ουρολογική Εταιρία – EAU, 2023)
Έτσι όσοι είναι άνω των 70 ετών κατά τη διάγνωση του καρκίνου και έχουν και άλλες παθήσεις ή εύθραυστη υγεία πρέπει να ελέγχονται και με γηριατρικές μεθόδους ώστε να υπολογίζεται το πιθανό υπόλοιπο της ζωής τους.
[Ένας καλός δείκτης προσδόκιμου επιβίωσης είναι η ταχύτητα με την οποία κινείται ο άνθρωπος σε 6 μέτρα απόσταση. Έτσι ένας άνδρας 75 ετών αν κινείται με ταχύτητα < 0.4 m/s η πιθανότητα του να ζήσει 10 χρόνια είναι 19%, ενώ αν κινείται με ταχύτητα >1.4 m/s η πιθανότητα του να ζήσει 10 χρόνια είναι 87%.]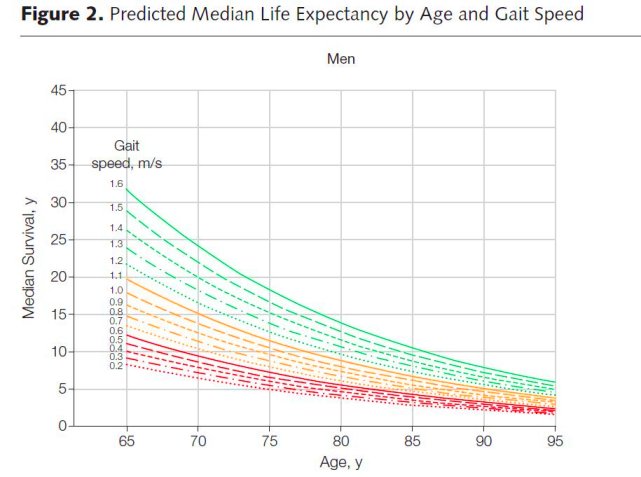 >> Ο γιατρός πρέπει να ενημερώνει τον ασθενή όχι μόνο για το όφελος της θεραπείας αλλά και τον κίνδυνο παρενεργειών από αυτές.
>> Ο γιατρός πρέπει να ενημερώνει τον ασθενή όχι μόνο για το όφελος της θεραπείας αλλά και τον κίνδυνο παρενεργειών από αυτές.
Οι ΠΑΡΕΝΕΡΓΕΙΕΣ κατά την προστατεκτομή** και οι μετέπειτα πιθανές βλάβες στη λειτουργία του ουροποιητικού, του εντέρου, τη στυτική δυσλειτουργία από την προστατεκτομή ή την ακτινοθεραπεία πρέπει να γνωστοποιούνται στον ασθενή ώστε να συναποφασίζει και αυτός για την ακολουθούμενη θεραπεία. Εξ’ άλλου η ζωή είναι δική του.
Γενικά η προστατεκτομή προκαλεί μακροχρόνια συχνότερη απώλεια ούρων (περίπου 20% vs 6%) και συχνότερη απώλεια στύσης (82% vs 73%), ενώ η ακτινοθεραπεία μαζί με τη χορήγηση αντιανδρογόνων, παρουσιάζει μακροχρόνια μεγαλύτερη πιθανότητα απώλειας κοπράνων (περίπου 8% vs 4%). (Δες πιο κάτω)
** Με τη λαπαροσκοπική ρομποτικά υποβοηθούμενη προστατεκτομή (55866), η πιθανότητα σοβαρών παρενεργειών είναι περίπου 5.3%, και ο κίνδυνος θανάτου 0.1% (ο μέσος κίνδυνος για άντρα 72 ετών με ΔΜΣ 30.45, χωρίς προβλήματα υγείας), όπως δείχνει ο υπολογιστής κινδύνου του Αμερικανικού Κολλεγίου Χειρουργών που βρίσκεται στη διεύθυνση του διαδικτύου:
http://riskcalculator.facs.org/RiskCalculator/
ΣΥΜΠΤΩΜΑΤΑ
Δυστυχώς τα συμπτώματα δεν υπάρχουν τα πρώτα χρόνια, και αν υπάρξουν δεν είναι ειδικά και μοιάζουν με της υπερτροφίας του προστάτη, π.χ. συχνουρία, δυσκολία στην ούρηση, αίσθημα καύσου κατά την ούρηση κλπ.
Επιπλέον μπορεί να εμφανιστεί αίμα στα ούρα ή στο σπέρμα.
ΜΕ ΜΕΓΑΛΥΤΕΡΗ ΛΕΠΤΟΜΕΡΕΙΑ
Η ΣΥΧΝΟΤΗΤΑ ΣΤΟΝ ΠΛΗΘΥΣΜΟ
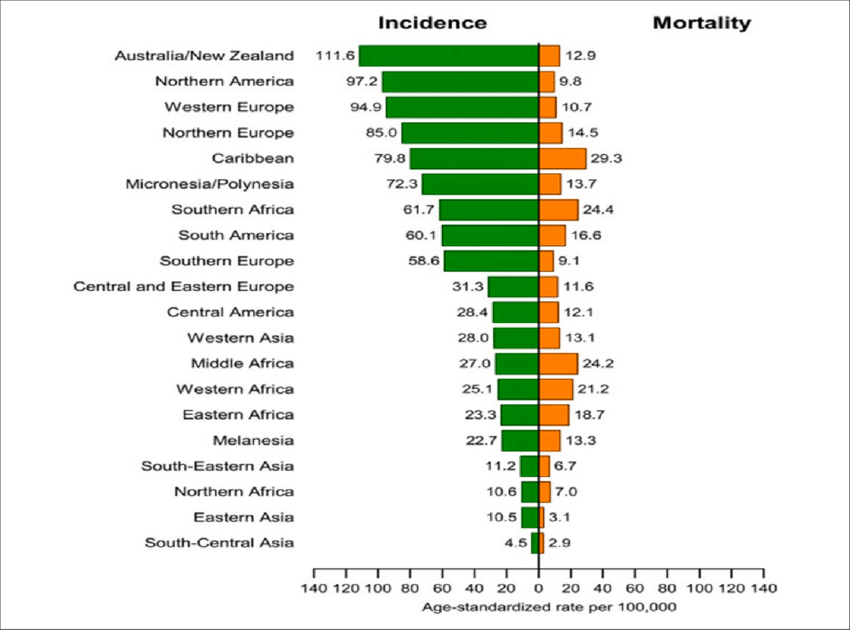
Ο καρκίνος του προστάτη είναι ο συχνότερος καρκίνος στους άντρες μετά τον καρκίνο του δέρματος και του πνεύμονα.
Εντοπίζεται 1 νέα περίπτωση καρκίνου του προστάτη ανά 800 περίπου άντρες, ανά έτος στην Ευρώπη.
Η μέση ηλικία κατά τη διάγνωση είναι τα 67 έτη και η πλειοψηφία των καρκίνων του προστάτη εντοπίζεται σε άντρες άνω των 65 ετών.
Κατά τη διάρκεια της ζωής του ένας στους 7-8 άντρες θα εμφανίσει καρκίνο του προστάτη.
ΑΙΤΙΟΛΟΓΙΑ
Η αιτία της δημιουργίας του καρκίνου του προστάτη είναι παρόμοια με των άλλων καρκίνων.
Οι Καρκίνοι προκαλούνται από διάφορες αιτίες που έχουν σαν αποτέλεσμα μεταλλάξεις σε συγκεκριμένα γονίδια που ευνοούν τον καρκίνο ή/και επιγενετικές αλλαγές (περιβαλλοντικές αλλαγές) σ’ αυτά τα γονίδια.
Η συσσώρευση μεταλλάξεων ή/και επιγενετικών αλλαγών διαρκεί συνήθως χρόνια ή δεκαετίες ώστε να δημιουργηθεί το πρώτο καρκινικό κύτταρο. (Δες πιο κάτω)
Οι επιγενετικές αλλαγές που σχετίζονται με αυξημένο κίνδυνο καρκίνου στον προστάτη είναι η συχνή κατανάλωση κόκκινου κρέατος, επεξεργασμένου κρέατος, γαλακτοκομικών, η αυξημένη λήψη αλκοόλ, το κάπνισμα, η χαμηλή (και η πολύ ψηλή) βιταμίνη D στο αίμα. Άλλες αιτίες θεωρούνται η φλεγμονή του προστάτη από χλαμύδια ή γονόκοκκο ή HPV 16, η φλεγμονώδης νόσος του εντέρου, το εντομοκτόνο Chlordecone (Kepone) κλπ.
Αντίθετα το Λυκοπένιο από μαγειρεμένες ντομάτες και τα προϊόντα Σόγιας σχετίζονται με μειωμένο κίνδυνο καρκίνου στον προστάτη.
Η Υπέρταση και η μεγαλύτερη από 102 cm περιφέρεια μέσης, σχετίζονται με μεγαλύτερη πιθανότητα ύπαρξης κλινικά σημαντικού καρκίνου στον προστάτη.
ΓΟΝΙΔΙΑ ΚΑΙ ΚΑΡΚΙΝΟΣ ΤΟΥ ΠΡΟΣΤΑΤΗ
Σε μερικούς άντρες με καρκίνο του προστάτη μπορεί να υπάρχουν κληρονομικά μεταφερόμενα μεταλλαγμένα γονίδια με συχνότερο και σημαντικότερο το BRCA2, που μπορεί να προέλθει από τον πατέρα ή και από τη μητέρα με καρκίνο του μαστού. Αυτά σχετίζονται με επιθετικούς καρκίνους.
Μέχρι 12 % όσων έχουν μετάσταση παρουσιάζουν μετάλλαξη σε 16 γονίδια με συχνότερο και κυριότερο το BRCA2 (5.3%). Ακολουθούν τα γονίδια CHEK2 (2.2%), ATM (1.8%), BRCA1 (1.1%) και άλλα.
Αν έχει συμβεί μετάλλαξη σε κάποιον πρόγονο που μειώνει τη δράση του γονιδίου BRCA2, η αντίστοιχη πρωτεΐνη BRCA2, δεν καταπιέζει τη δημιουργία όγκων μέσω του μηχανισμού επιδιόρθωσης βλαβών DNA κατά τις κυτταρικές διαιρέσεις.
Η μετάλλαξη στο γονίδιο BRCA2 αποτελεί ανεξάρτητο παράγοντα κινδύνου για μεταστάσεις και αύξηση της πιθανότητας θανάτου από τον καρκίνο.
Προς το παρόν η μετάλλαξη στο γονίδιο BRCA2, δεν αποτρέπει την συχνή ενεργή παρακολούθηση όπου αυτή μπορεί να εφαρμοστεί.
Όπως αναφέρθηκε πιο πάνω σημαντικό ποσοστό του καρκίνου του προστάτη οφείλεται σε κληρονομικά μεταφερόμενα μεταλλαγμένα γονίδια με συχνότερο και σημαντικότερο το BRCA2. >> Όμως υπάρχει και σημαντικό ποσοστό του καρκίνου του προστάτη που οφείλεται στην αθροιστική δράση (π.χ. μελέτη BARCODE 1) μεταλλαγμένων γονιδίων (SNP) που από μόνα τους προκαλούν μικρή μόνο αύξηση της πιθανότητας καρκίνου του προστάτη (πολυγονιδιακό άθροισμα κινδύνου ήPRS).
https://ascopubs.org/doi/pdfdirect/10.1200/JCO.2024.42.16_suppl.10500
Γονιδιακός έλεγχος θα γίνει αν υπήρξαν άντρες στην οικογένεια με καρκίνο του προστάτη κάτω των 60 ετών, ή αν κάποιος άντρας στην οικογένεια πέθανε από αυτόν τον καρκίνο ή σε οικογενειακό ιστορικό διαφόρων καρκίνων στην ίδια πλευρά της οικογένειας π.χ. του παχέως εντέρου, της ουροδόχου κύστεως, του παγκρέατος και από την μητέρα κυρίως καρκίνος μαστού ή ωοθηκών.
ΟΙ ΕΞΕΤΑΣΕΙΣ ΓΙΑ ΤΗ ΔΙΑΓΝΩΣΗ ΤΟΥ ΚΑΡΚΙΝΟΥ ΤΟΥ ΠΡΟΣΤΑΤΗ
>> Σήμερα η διάγνωση του καρκίνου του προστάτη σε ασυμπτωματικό άντρα ξεκινά με την εύρεση αυξημένου PSA > 3 ng/ml σε προληπτικό αιματολογικό έλεγχο και ακολουθεί έλεγχος με δακτυλική εξέταση του προστάτη (DRE).
>> Αν η δακτυλική εξέταση του προστάτη είναι αρνητική και η τιμή του PSA είναι από 3 ως 10 ng/ml, είτε διενεργείται πολυπαραμετρική μαγνητική τομογραφία του προστάτη (mpMRI) είτε χρησιμοποιείται υπολογιστής κινδύνου (δες πιο κάτω) για να αποφασιστεί αν θα διενεργηθεί βιοψία.
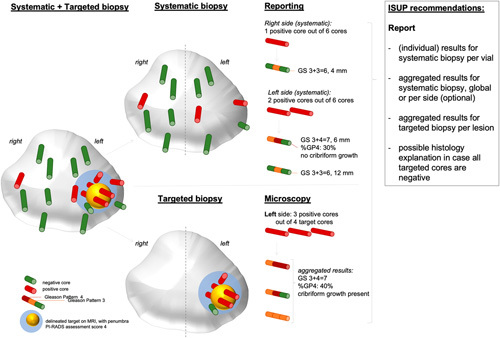
Αν η mpMRI δείξει αλλοιώσεις PI-RADS (Prostate Imaging Reporting and Data System) > 2, διενεργείται στοχευμένη βιοψία του προστάτη (fusion βιοψία), καθοδηγούμενη από τα ευρήματα της mpMRI και επιπλέον συστηματική βιοψία. Τα δείγματα της βιοψίας πρέπει να είναι περισσότερα από 12.
Η βιοψία μπορεί να γίνει μέσω του ορθού, όμως λόγω αυξημένης πιθανότητας επιπλοκών (π.χ. από είσοδο μικροβίων από το παχύ έντερο) θεωρείται καλύτερη η βιοψία μέσω του περινέου.
Ακολουθεί ιστολογική εξέταση των δειγμάτων όπου εφαρμόζεται η μέθοδος Gleason. (Δες πιο κάτω)
** Αν γίνει στοχευμένη fusion βιοψία μετά από πολυπαραμετρική MRI (η συνήθης πρακτική σήμερα), ο αριθμός των θετικών δειγμάτων (cores) δεν αποτελεί ένδειξη του όγκου του καρκίνου ή της έκτασης της νόσου, οπότε πολλές θετικές λήψεις από τον ίδιο όγκο, θεωρούνται σαν μία (AUA/ASTRO 2022 και EAU 2023).
Επιπλέον, αν διαγνωστεί καρκίνος κατηγορίας ISUP > 2, αυτός θεωρείται καλύτερης πρόγνωσης αν διαγνώστηκε με στοχευμένη βιοψία (EAU 2023).
Συστηματική και Στοχευμένη βιοψία προστάτη
https://europepmc.org/article/pmc/pmc7382533
>> Η πολυπαραμετρική μαγνητική τομογραφία (mpMRI) του προστάτη, με τομογράφο 3 Tesla, έχει μεγάλη ευαισθησία στην ανίχνευση καρκίνου ISUP grade 3 και πάνω, περίπου 95%, όμως δεν ανιχνεύει μόνο τον καρκίνο, ανιχνεύει και άλλες παθολογίες του προστάτη, π.χ. προστατίτιδα. Αυτή δυστυχώς έχει μικρή ειδικότητα περίπου 40% (δηλαδή στο 60% των περιπτώσεων που δείχνει ότι υπάρχει καρκίνος, αυτός ΔΕΝ υπάρχει). (EAU 2023)
>> Υπ’ όψιν ότι χρειάζεται μεγάλη εξειδίκευση στην πολυπαραμετρική μαγνητική τομογραφία του προστάτη από τον ακτινολόγο.
Η πιθανότητα κλινικά σημαντικού καρκίνου στην mpMRI είναι ανάλογη της τιμής PI-RADS (Prostate Imaging Reporting and Data System).
Αν η mpMRI δείξει αλλοιώσεις PI–RADS > 2, διενεργείται στοχευμένη βιοψία του προστάτη (fusion βιοψία), καθοδηγούμενη από τα ευρήματα της mpMRI (και επιπλέον συστηματική βιοψία)
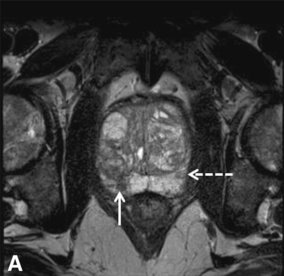
Με το συνεχόμενο βέλος φαίνεται μορφολογία PI-RADS 4 και με το διακεκομμένο βέλος ψευδώς PI-RADS 4.
Σε τιμή PI-RADS 1-2 η πιθανότητα καρκίνου είναι 7%, σε τιμή 3 η πιθανότητα είναι 11%, σε τιμή 4 η πιθανότητα είναι 37% και σε τιμή 5 η πιθανότητα είναι 70%.
ΤΙΜΕΣ PI-RADS ΚΑΙ PSA-D
>> Σε PI-RADS 4-5 χρειάζεται βιοψία άσχετα από την τιμή του PSA-D (πυκνότητα PSA – Δες πιο κάτω).
>> Σε PI-RADS 1–2 και PSA-D > 0.2 ng/mL/cc, πιθανώς χρειάζεται βιοψία.
>> Σε PI-RADS 3 και PSA-D < 0.1 ng/mL/cc, ΔΕΝ χρειάζεται βιοψία. (Δες πιο κάτω).
(Υπ’ όψιν ότι όπου δεν συνιστάται βιοψία η πιθανότητα να υπάρχει κλινικά σημαντικός καρκίνος κυμαίνεται από 0-10%, όμως θεωρείται κίνδυνος αποδεκτός ιατρικά)
>> Πριν τη διενέργεια βιοψίας μπορεί να χρησιμοποιηθούν προγνωστικοί υπολογιστές για την εύρεση της πιθανότητας του καρκίνου.
Προγνωστικός υπολογιστής υπάρχει στη διεύθυνση του διαδικτύου:
http://www.prostatecancer-riskcalculator.com/seven-prostate-cancer-risk-calculators
Ο υπολογιστής 3-4 στην πιο πάνω διεύθυνση υπολογίζει την πιθανότητα ύπαρξης καρκίνου του προστάτη. Σ’ αυτόν λαμβάνονται υπ’ όψιν το PSA, η δακτυλική εξέταση από τον ουρολόγο, ο όγκος του προστάτη, η ηλικία και η τιμή PI-RADS. Αν ο υπολογιστής δείξει πιθανότητα μικρότερη από 12.5%, ίσως μπορεί να αποφευχθεί η βιοψία.
>> Η δακτυλική εξέταση του προστάτη (DRE) δυστυχώς έχει χαμηλή ευαισθησία, περίπου 55% (ανιχνεύονται μόνο οι 55 από τους 100 που έχουν καρκίνο). Η ειδικότητα της είναι περίπου 63%, δηλαδή οι 37 δεν έχουν καρκίνο από τους 100 που υποθέτει ο ουρολόγος ότι υπάρχει καρκίνος.
>> Ο έλεγχος του PSA ξεκινά συνήθως από την ηλικία των 50 ετών. Όμως σε ορισμένες περιπτώσεις ξεκινά νωρίτερα: Αν υπάρχει μετάλλαξη του γονιδίου BRCA2, ξεκινά από τα 40, αν υπάρχει οικογενειακό ιστορικό καρκίνου του προστάτη ή αν υπάρχει καταγωγή από Αφρική, ξεκινά από τα 45 έτη.
>> Αντί του PSA, ο καλύτερος από τους δείκτες (που σχετίζονται με το PSA) θεωρείται ο υπολογισμός της πυκνότητας του, ή PSA density, που υπολογίζεται διαιρώντας το PSA με τον όγκο του προστάτη, σε κυβικά εκατοστά. Αν η τιμή του PSA density είναι μεγαλύτερη από 0.15 ng/mL/cc, τότε υπάρχει μεγαλύτερη πιθανότητα κλινικά σημαντικού καρκίνου. Αν αυτή είναι κάτω από 0.09 ng/mL/cc υπάρχει ελάχιστη πιθανότητα να βρεθεί κλινικά σημαντικός καρκίνος.
>> Μετά την εύρεση καρκίνου στον προστάτη ακολουθούν αξονικές τομογραφίες και σπινθηρογράφημα οστών για να φανεί αν υπάρχουν μεταστάσεις.
>> Το PSMA PET/CT (με Gallium 68 PSMA-11 ή Piflufolastat F-18 PSMA) είναι ακριβέστερο για σταδιοποίηση από τις αξονικές τομογραφίες και το σπινθηρογράφημα των οστών, για όσους έχουν υψηλού κινδύνου καρκίνο και θα προτιμάται στο μέλλον, αν προκύψει βελτίωση της θεραπείας με τη χρήση του.
Πάντως σε υψηλού κινδύνου καρκίνο μπορεί να χρησιμοποιηθεί το PSMA PET/CT αν η αξονικές τομογραφίες και το σπινθηρογράφημα των οστών είναι φυσιολογικά. (ΑUA 2022)
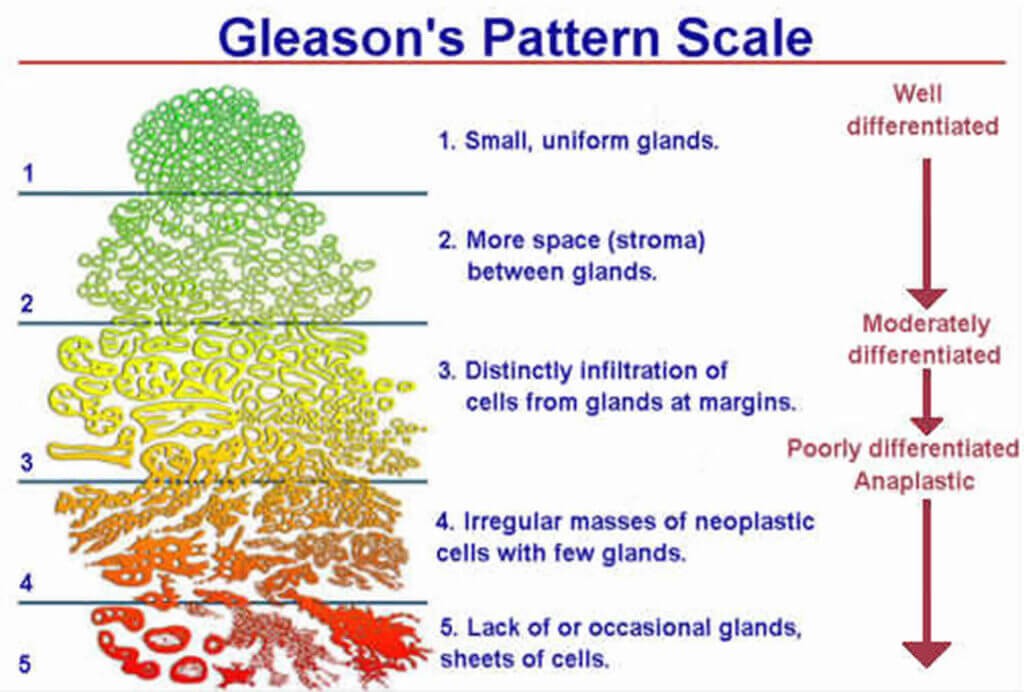
ΤΟ GLEASON SCORE
Η επιθετικότητα του αδενοκαρκινώματος (αυτό υπάρχει στο 95% των περιπτώσεων καρκίνου) του προστάτη ιστολογικά, βάσει των αποτελεσμάτων της βιοψίας έχει επικρατήσει να εκφράζεται με το Gleason score.
Σ’ αυτό βαθμολογείται το πόσο διαφέρουν (και η αρχιτεκτονική τους διάταξη) τα καρκινικά κύτταρα από τα φυσιολογικά κύτταρα του προστάτη. Όσο περισσότερο διαφέρουν τόσο επιθετικότερος είναι ο καρκίνος.
Η μέγιστη διαφορά βαθμολογείται με 5 και η μικρότερη με 1 Gleason score. Η τελική βαθμολογία προκύπτει από το άθροισμα της επικρατούσας μορφολογίας (που αναφέρεται πρώτη) και της δεύτερης συχνότερης μορφολογίας (αν υπάρχουν δύο μορφολογίες).
Αν δεν υπάρχουν δυο μορφολογίες διπλασιάζεται ο βαθμός της υπάρχουσας μορφολογίας.
Έτσι το Gleason score έχει τιμή από 2 ως 10, με το 10 να έχει τη χειρότερη πρόγνωση.
Για παράδειγμα το άθροισμα Gleason 7 (μέτριας επικινδυνότητας) μπορεί να προκύψει είτε από 3+4 οπότε ο καρκίνος θεωρείται ευνοϊκός μετρίου κινδύνου (βαθμός ISUP 2) είτε από 4+3 (βαθμός ISUP 3) οπότε ο καρκίνος θεωρείται ΜΗ ευνοϊκός μετρίου κινδύνου (Σημασία έχει και το ποσοστό της μορφολογίας 4).
ΜΕ ΠΕΡΙΣΣΟΤΕΡΕΣ ΛΕΠΤΟΜΕΡΕΙΕΣ
ΚΑΤΑΤΑΞΗ ΣΕ ΟΜΑΔΕΣ ΓΙΑ ΠΡΟΓΝΩΣΗ ΚΑΙ ΘΕΡΑΠΕΙΑ
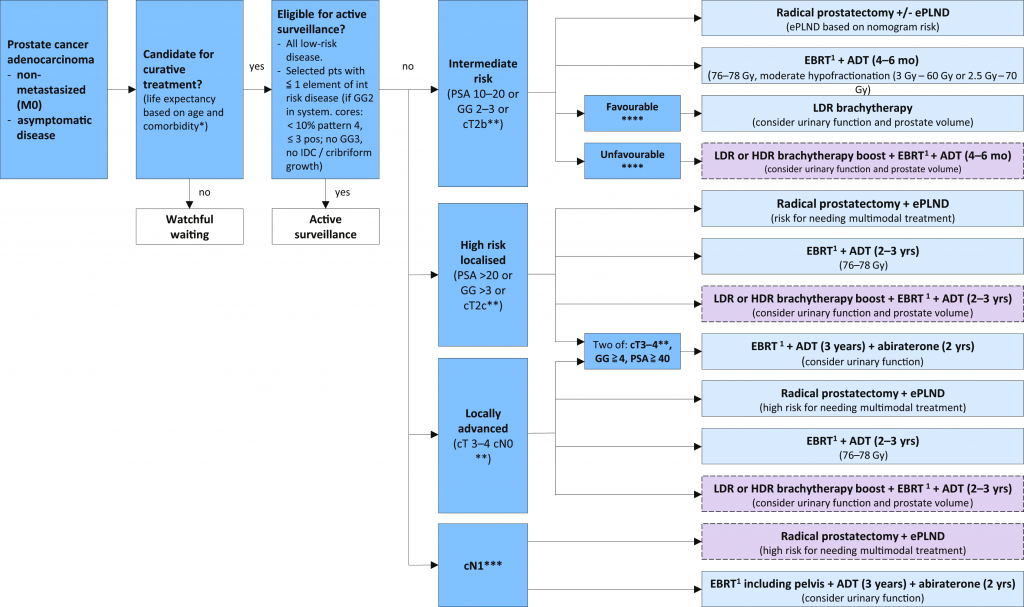
Ο εντοπισμένος καρκίνος του προστάτη για λόγους πρόγνωσης και θεραπείας κατατάσσεται από την Ευρωπαϊκή Ουρολογική Εταιρία (οδηγίες 2023) βάσει του κλινικού σταδίου (Tumour, Node, Metastasis ή TNM), της τιμής του PSA και του Gleason score σε χαμηλού κινδύνου, μέτριου κινδύνου και υψηλού κινδύνου.
Η κατάταξη αφορά κυρίως τη βιοχημική επανεμφάνιση (αύξηση PSA) μετά από ριζική προστατεκτομή ή εξωτερική ακτινοθεραπεία (EBRT).
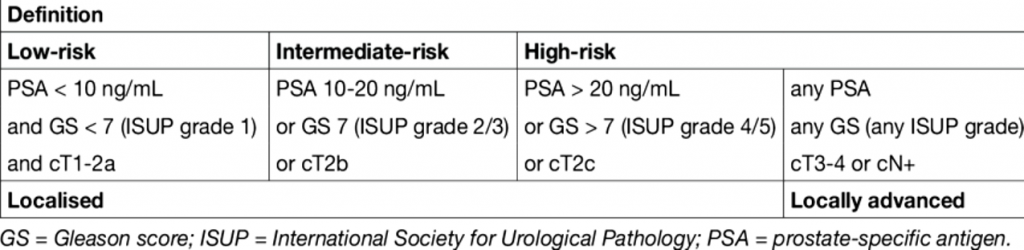
# Ο ΧΑΜΗΛΟΥ ΚΙΝΔΥΝΟΥ εντοπισμένος καρκίνος του προστάτη έχει PSA < 10 ng/ml και Gleason score < 7 (βαθμού ISUP 1) και είναι κλινικού σταδίου cΤ1-2a*.
intraductal or cribriform histology, should be excluded.
## 0 ΜΕΤΡΙΟΥ ΚΙΝΔΥΝΟΥ εντοπισμένος καρκίνος του προστάτη έχει PSA 10-20 ng/ml ή Gleason score 7 [βαθμού ISUP 2 (3+4) ή ISUP 3 (4+3)] ή είναι κλινικού σταδίου cΤ2b*.
[Οι Αγγλικές και Αμερικανικές οδηγίες, τον μετρίου κινδύνου καρκίνο τον διαχωρίζουν σε ευνοϊκό και ΜΗ ευνοϊκό.
Οι προγνωστικές ομάδες σύμφωνα με το πανεπιστήμιο του Cambridge για τον καρκίνο μέτριου κινδύνου είναι η ομάδα 2 (favourable intermediate risk) με Gleason score 3 + 4 = 7 ή PSA 10-20 ng/ml και κλινικό στάδιο T1–T2, και η ομάδα 3 (unfavourable intermediate risk) με Gleason score 3 + 4 = 7 και PSA 10-20 ng/ml και κλινικό στάδιο T1–T2 ή με Gleason score 4 + 3 = 7 και κλινικό στάδιο T1–T2]
Οι Αμερικανικές οδηγίες (AUA) για τη σταδιοποίηση λαμβάνουν επιπλέον υπ’ όψιν και τον όγκο του καρκίνου στη βιοψία.
Έτσι ο μετρίου κινδύνου καρκίνος διαιρείται: α) Σε ευνοϊκό, με Gleason score 3+4 και ποσοστό θετικών δειγμάτων βιοψιών (από τα συνολικά ληφθέντα δείγματα) < 50%, και β) σε ΜΗ ευνοϊκό με Gleason score 4+3 και ποσοστό θετικών** δειγμάτων βιοψιών > 50%.
### 0 υψηλού κινδύνου εντοπισμένος καρκίνος του προστάτη έχει PSA >20 ng/ml ή έχει Gleason score >7 (βαθμού ISUP 4 ή 5) ή είναι κλινικού σταδίου cΤ2c*. Υψηλού κινδύνου θεωρείται και όποιος καρκίνος έχει επεκταθεί έξω από την προστατική καψούλα, ανεξάρτητα από την τιμή του PSA και του Gleason score.
ISUP = International Society for Urological Pathology.
ISUP grade 1 = score Gleason 2-6 / ISUP grade 2 = score Gleason 3+4
ISUP grade 3 = score Gleason 4+3 / ISUP grade 4 = score Gleason 8
ISUP grade 5 = score Gleason 9-10.
*Βάσει της Δακτυλικής εξέτασης ΜΟΝΟ.
>> Κλινικό στάδιο cT1 στάδιο σημαίνει ότι ο όγκος ΔΕΝ είναι ψηλαφητός με τη δακτυλική εξέταση.
Κλινικό στάδιο cT2 σημαίνει ότι ο όγκος ψηλαφείται με τη δακτυλική εξέταση μόνο, και ΔΕΝ επεκτείνεται εκτός του προστάτη.
Ο χαμηλού κινδύνου ψηλαφείται σε λιγότερο από το μισό του ενός λοβού του προστάτη: στάδιο cΤ2a*
Ο μέτριου κινδύνου ψηλαφείται σε περισσότερο από το μισό ενός λοβού μόνο: στάδιο cΤ2b* και
Ο υψηλού κινδύνου ψηλαφείται και στους 2 λοβούς: στάδιο cΤ2c*.
Τα κλινικά στάδια δημιουργούνται ΜΟΝΟ βάσει της δακτυλικής εξέτασης γιατί οι μελέτες στις οποίες βασίστηκαν οι πληροφορίες για κατάταξη 15ετούς κινδύνου είναι παλιότερες, πριν την ύπαρξη της πολυπαραμετρικής μαγνητικής τομογραφίας του προστάτη (mpMRI) και της τομογραφίας εκπομπής ποζιτρονίων με PSMA (Prostate-Specific Membrane Antigen).
Τυχόν επιπλέον ευρήματα από απεικονιστικές μεθόδους ή από τη βιοψία (όσον αφορά στην έκταση του καρκίνου στον προστάτη) αναφέρονται ξεχωριστά.
Αναμένεται να αλλάξει στο μέλλον η σταδιοποίηση όταν θα έχουμε τα αποτελέσματα 10ετίας και 15ετίας με τις μελέτες που διενεργούνται τώρα με τις νέες απεικονιστικές μεθόδους (την mpMRI και την τομογραφία εκπομπής ποζιτρονίων με PSMA) και τη στοχευμένη βιοψία (βάσει των αποτελεσμάτων της mpMRI) του προστάτη.
ΘΕΡΑΠΕΙΑ ΑΝΑΛΟΓΩΣ ΤΟΥ ΣΤΑΔΙΟΥ ΣΤΟΝ ΕΝΤΟΠΙΣΜΕΝΟ ΚΑΡΚΙΝΟ
Όσοι ασυμπτωματικοί έχουν προσδόκιμο ζωής < 10 χρόνια, ασχέτως σταδίου, λαμβάνουν μόνο παρηγορητική θεραπεία όταν χρειαστεί, για να αποφευχθούν τοξικές παρενέργειες από τη θεραπεία. Η πρακτική αυτή ονομάζεται Προσεκτική Αναμονή.
Πριν τη θεραπεία ο γιατρός πρέπει να γνωστοποιεί τα οφέλη και τις παρενέργειες της κάθε θεραπείας στον ασθενή και να συναποφασίζουν για την θεραπεία.
Πιο πάνω οι οδηγίες της Ευρωπαϊκής Ουρολογικής Εταιρίας, 2023
ΧΑΜΗΛΟΥ ΚΙΝΔΥΝΟΥ: Σχεδόν όλοι χρειάζονται μόνο ενεργή, προσεκτική παρακολούθηση, με PSA και δακτυλική εξέταση ανά 6μηνο, mpMRI αν το PSA διπλασιαστεί σε λιγότερο από 3 χρόνια και βιοψίες κάθε 2-3 χρόνια, ώστε αν αυξηθεί η επιθετικότητα του καρκίνου, να ξεκινήσει η θεραπεία του, εφ’ όσον το προσδόκιμο επιβίωσης είναι μεγαλύτερο από 10 χρόνια. (Μελέτη ProtecT: Δες πιο κάτω)
ΜΕΤΡΙΟΥ ΚΙΝΔΥΝΟΥ ΕΥΝΟΙΚΟΣ: Η θεραπευτική επιλογή περιέχει την ενεργή παρακολούθηση (αν το ποσοστό με Gleason score 4 ήταν μικρό) ή τη ριζική προστατεκτομή ή ακτινοθεραπείες* (εξωτερική ακτινοβολία EBRT) ή η εμφύτευση ραδιενεργού υλικού στον προστάτη με χαμηλή δόση ακτινοβολίας (LDR), με ή χωρίς χορήγηση αντι-ανδρογόνων – ADΤ για 4 ως 6 μήνες. (Δες πιο κάτω)
Οι Ευρωπαϊκές οδηγίες (EAU), συνηγορούν υπέρ της χορήγησης ADΤ, ενώ οι Αμερικανικές (AUA) εναντίον της χορήγησης. Αναμένονται τα αποτελέσματα νέων μελετών για το θέμα.
(Γενικά τα αντι-ανδρογόνα μειώνουν τη θνητότητα από τον μετρίου κινδύνου καρκίνο του προστάτη και τις μεταστάσεις αλλά δεν επηρεάζουν τη συνολική θνητότητα από όλες τις αιτίες)
ΜΕΤΡΙΟΥ ΚΙΝΔΥΝΟΥ ΜΗ ΕΥΝΟΙΚΟΣ: Η θεραπευτική επιλογή περιέχει μόνο τη ριζική προστατεκτομή ή τις ακτινοθεραπείες (εξωτερική ακτινοβολία EBRT) ή συνδυασμό EBRT και βραχυθεραπείας (δες πιο κάτω) αν είναι καλή η λειτουργία του ουροποιητικού συστήματος) και ταυτόχρονη χορήγηση αντι-ανδρογόνων – ADΤ για 4 ως 6 μήνες.
ΥΨΗΛΟΥ ΚΙΝΔΥΝΟΥ
Η θεραπευτική επιλογή είναι ριζική προστατεκτομή ή ακτινοθεραπείες (εξωτερική ακτινοβολία EBRT) ή συνδυασμός EBRT και βραχυθεραπείας αν είναι καλή η λειτουργία του ουροποιητικού συστήματος) με ταυτόχρονη χορήγηση αντι-ανδρογόνων (ADΤ) για 2-3 χρόνια.
Στον υψηλού κινδύνου ίσως μπορεί να ακτινοβοληθούν και οι πυελικοί λεμφαδένες παρ’ όλο που δεν υπάρχει όφελος στη συνολική θνητότητα και είναι αυξημένη η μακροχρόνια τοξικότητα κυρίως στην ουροδόχο κύστη – AUA 2022 (Δες πιο κάτω),
>> Άλλες μορφές θεραπείας όπως η καταστροφή με κρυοθεραπεία, η υψηλής ενέργειας υπέρηχοι (HIFU) και η focal photodynamic therapy (PDT), θεωρούνται ακόμη πειραματικές, και μπορεί να διενεργηθούν μόνο στα πλαίσια επίσημης μελέτης.
Η ΒΙΟΧΗΜΙΚΗ ΕΠΑΝΕΜΦΑΝΙΣΗ
>> Περίπου το 33% των ασθενών παρουσιάζουν βιοχημική επανεμφάνιση μετά από τη θεραπεία.
>> Κλινικές μεταστάσεις δημιουργούνται περίπου 7-8 χρόνια μετά από βιοχημική επανεμφάνιση.
Σαν βιοχημική επανεμφάνιση ορίζεται:
a) Mετά από εγχείρηση η επίμονη* αύξηση του PSA πάνω από το 0.2 ng/mL αφού είχε μηδενιστεί πριν.
https://www.auajournals.org/doi/10.1097/JU.0000000000003892
b) Mετά από ακτινοθεραπεία η επίμονη* αύξηση του PSA πάνω από 2 ng/mL από το χαμηλότερο επίπεδο (ναδίρ) που έφτασε.
[Το μέσο PSA 6 μήνες μετά από ακτινοθεραπεία EBRT και 6μηνη θεραπεία στέρησης Ανδρογόνων (ADT) είναι 0.1 ng/ml (από 0-19). Στους περισσότερους αυτό βρέθηκε κάτω από 0.1 ng/ml και αυτοί είχαν καλύτερη πρόγνωση.
https://www.sciencedirect.com/science/article/abs/pii/S0360301616328784]
* Επίμονη είναι αν τουλάχιστον 3 τιμές του PSA με μεσοδιαστήματα > 1 μήνα βρεθούν αυξημένες.
O έλεγχος του PSA αρχικά γίνεται τον 3ο και 6ο μήνα, μετά ανά 6μηνο μέχρι τον 3ο χρόνο και μετά ανά έτος.
>> Για να διευκρινιστεί που εντοπίζονται τα καρκινικά κύτταρα θα διενεργηθεί PSMA PET/CT και mp MRI σε όσους μπορούν να αντέξουν νέα θεραπεία, με προσδόκιμο επιβίωσης πάνω από 10 χρόνια, ώστε να φανεί αν αυτά βρίσκονται σε μετάσταση ή στον προστάτη.
>> Όμως δεν έχουν όλοι με βιοχημική επανεμφάνιση αυξημένο κίνδυνο θανάτου, αλλά ορισμένες υποκατηγορίες.
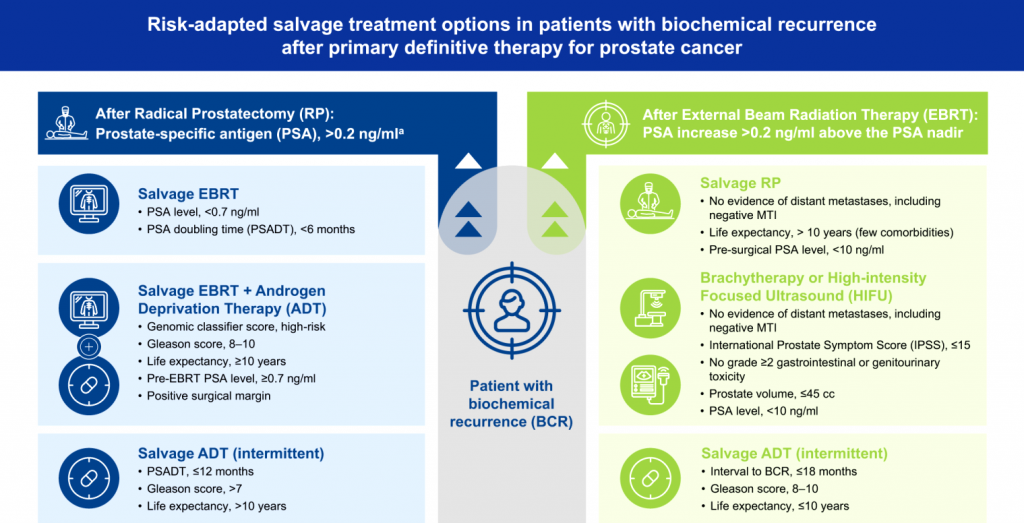
### Μετά από εγχείρηση, αυξημένος κίνδυνος θανάτου παρατηρείται σε όσους έχουν ISUP grade 4–5 ή το PSA έχει διπλασιαστεί σε λιγότερο από 1 χρόνο (PSA–DT).
>> Σ’ αυτή την περίπτωση προσφέρεται ακτινοθεραπεία διάσωσης, αν το προσδόκιμο επιβίωσης είναι πάνω από 10 χρόνια.
Το PSA–DT υπολογίζεται στην διεύθυνση:
https://www.mdcalc.com/calc/10198/psa-doubling-time-psadt-calculator
### Μετά από ακτινοθεραπείες, αυξημένος κίνδυνος θανάτου παρατηρείται σε όσους έχουν ISUP grade 4–5 ή αν το διάστημα μέχρι να υπάρξει επίμονη* αύξηση του PSA πάνω από 2 ng/mL από το χαμηλότερο επίπεδο (ναδίρ) που έφτασε, ήταν λιγότερο από 18 μήνες.
(Επιπλέον αυξημένο κίνδυνο έχουν όσοι είναι μεγάλης ηλικίας και αν το PSA ήταν ψηλό πριν τις ακτινοθεραπείες).
>> Σ’ αυτή την περίπτωση γίνεται ριζική εγχείρηση διάσωσης ή βραχυθεραπεία ή στερεοτακτική ακτινοθεραπεία σε τοπική επανεμφάνιση (μετά από βιοψία) στα πλαίσια μελέτης σε εξειδικευμένο κέντρο, αν το προσδόκιμο επιβίωσης είναι πάνω από 10 χρόνια.
>> Στους άλλους με μειωμένο κίνδυνο, προσφέρεται παρακολούθηση.
>> Δεν προσφέρεται θεραπεία με αντι-ανδογόνα αν το PSA χρειάστηκε περισσότερο από 12 μήνες για να διπλασιαστεί (PSA–DT).
https://www.nature.com/articles/s41391-023-00712-z
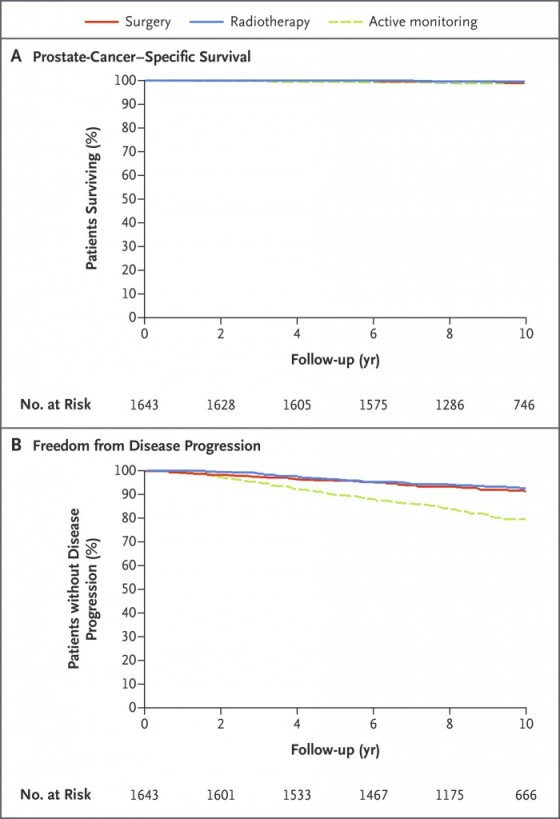
Η ΜΕΛΕΤΗ ProtecT
Τα αποτελέσματα 15ετίας της μελέτης ProtecT, (τα 2/3 των καρκίνων ήταν χαμηλού κινδύνου, το 24% ήταν μέτριου κινδύνου και το 9% ήταν υψηλού κινδύνου) για άντρες 50 ως 69 ετών έδειξαν παρόμοια θνητότητα από τον καρκίνο του προστάτη, περίπου 2.7%, στις 3 ομάδες, της ενεργής παρακολούθησης, της εγχείρησης, και της ακτινοθεραπείας, παρ’ όλο που οι μεταστάσεις ήταν σχεδόν διπλάσιες στο σκέλος της ενεργής παρακολούθησης (9.4% vs 4.7% vs 5%).
Η θνητότητα από οποιαδήποτε αιτία ήταν 21.7%, και ήταν παρόμοια στις 3 ομάδες.
>> Σε όσους ο καρκίνος Μετρίου κινδύνου, δεν αντιμετωπίστηκε με προστατεκτομή ή ακτινοβολίες, η θνητότητα από τον καρκίνο είναι 13% στα 10 χρόνια και 19.6% στα 15 χρόνια.
Οι ΠΑΡΕΝΕΡΓΕΙΕΣ στην ίδια μελέτη:
Στα 7-12 χρόνια υπάρχει απώλεια ούρων που χρειάζεται πάνες στο 21% όσων υποβάλλονται σε εγχείρηση και στο 5.5% όσων υποβάλλονται σε ακτινοθεραπείες.
Στα 7 χρόνια δεν είχαν επαρκή στύση για συνεύρεση το 82% όσων υποβάλλονται σε εγχείρηση και το 73% όσων υποβάλλονται σε ακτινοθεραπείες.
Στα 12 χρόνια υπήρχε απώλεια κοπράνων στο 6% όσων υποβάλλονται σε εγχείρηση και το 12% όσων υποβάλλονται σε ακτινοθεραπείες.
>> Παρενέργειες σύμφωνα με τον Αγγλικό οργανισμό NICE
Μέτρια ή Σοβαρή ΑΚΡΑΤΕΙΑ ΟΥΡΩΝ παρατηρείται στο 6μηνο στο 4% σε ενεργή παρακολούθηση στο 6% στην ακτινοθεραπεία και στο 19% σε όσους υποβάλλονται σε εγχείρηση.
Στα 6 χρόνια τα αντίστοιχα ποσοστά ήταν 8%, 5% και 13%.
Ακράτεια κοπράνων πάνω από 1 φορά την εβδομάδα στα 6 χρόνια παρατηρείται στο 3% στην ενεργή παρακολούθηση, στο 4% στην ακτινοθεραπεία και στο 2% στην εγχείρηση.
Επιπλέον υπάρχει μια ελάχιστη αύξηση της πιθανότητας καρκίνου του ορθού από την ακτινοθεραπεία.
ΟΙ ΑΚΤΙΝΟΘΕΡΑΠΕΙΕΣ
Σε όσους έχουν ευνοϊκό μέτριας επικινδυνότητας εντοπισμένο καρκίνο του προστάτη και επιλέξουν την ακτινοβολία, υπάρχουν 2 επιλογές, η εξωτερική ακτινοβολία (External beam radiation therapy – EBRT) ή η εμφύτευση ραδιενεργού υλικού στον προστάτη χαμηλής δόσης ακτινοβολίας (LDR) αν είναι καλή η λειτουργία του ουροποιητικού συστήματος.
Σε όσους έχουν ΜΗ ευνοϊκό μέτριας επικινδυνότητας καρκίνο και σε όσους έχουν υψηλού κινδύνου εντοπισμένο καρκίνο του προστάτη και επιλέξουν την ακτινοβολία, υπάρχουν 2 επιλογές, η εξωτερική ακτινοβολία (EBRT) ή ενδεχομένως συνδυασμός EBRT συν βραχυθεραπεία (LDR ή HDR) αν είναι καλή η λειτουργία του ουροποιητικού συστήματος.
Η ΕΞΩΤΕΡΙΚΗ ΑΚΤΙΝΟΘΕΡΑΠΕΙΑ
Η εξωτερική ακτινοθεραπεία από γραμμικό επιταχυντή EBRT (ακτινοβολία φωτονίων – ακτίνες Χ), είναι διαμορφούμενης έντασης ακτινοθεραπεία (IMRT) με κλιμάκωση της δόσης, που καθοδηγείται από εικόνες (Image Guided Radiotherapy ή IGRT) με συνολική δόση 76–78 Gray (Gy) ή μέτρια υποκλασματοποίηση με 60 Gy/σε 20 μέρες σε 4 εβδομάδες ή 70 Gy/σε 28 μέρες (fx) σε 6 εβδομάδες.
[ή μπορεί να χορηγηθεί η ογκομετρικά διαμορφούμενη τοξοειδής ακτινοθεραπεία (volumetric modulated arc therapy ή VMAT) που καθοδηγείται από εικόνες (IGRT). Αυτή διαρκεί λιγότερο, 2-3 λεπτά συνολικά]
Μπορεί να χρησιμοποιηθεί σχήμα ακτινοθεραπείας (1.8–2 Gy/fx) των 7 – 8 εβδομάδων (38 μέρες) με συνολική δόση 76–78 Gy ή σχήμα μέτριας υποκλασματοποίησης (2.5–3.4 Gy/fx) των 6 εβδομάδων (28 μέρες) με συνολική δόση 70 Gy ή με σχήμα 4 εβδομάδων (20 μέρες) με συνολική δόση 60 Gy.
>> Υπ’ όψιν ότι η ακτινοβολία με πρωτόνια ΔΕΝ είναι καλύτερη από τις υπόλοιπες.
>> Οι παρενέργειες της ακτινοβολίας οφείλονται στην ακτινοβόληση των γειτονικών υγιών οργάνων και είναι: Από το ουροποιητικό δυσουρία, συχνή ούρηση, αιματουρία κλπ., από το έντερο διάρροιες, αιμορραγία από το ορθό κλπ. Επίσης εξάντληση και απώλεια στύσης.
Σοβαρές παρενέργειες παρατηρούνται περίπου στο 2% των θεραπευομένων.
Η ΒΡΑΧΥΘΕΡΑΠΕΙΑ
Η βραχυθεραπεία είναι η εσωτερική ακτινοβόληση του προστάτη με τοποθέτηση ραδιενεργών εμφυτευμάτων. Για να τοποθετηθούν αυτά προϋποτίθεται καλή λειτουργία του ουροποιητικού συστήματος.
Αυτές είναι δύο ειδών: Η Χαμηλής Δόσης (LDR), όπου τα εμφυτεύματα, κυρίως με ραδιενεργό Iodine-125, παραμένουν στον προστάτη και ακτινοβολούν για μερικούς μήνες, και η Υψηλής Δόσης προσωρινή ακτινοβολία (HDR) διάρκειας λεπτών με ραδιενεργό Iridium-192.
Η Χαμηλής Δόσης (LDR) μπορεί να χρησιμοποιηθεί και σαν μονοθεραπεία στον ευνοϊκό μέτριου κινδύνου καρκίνο.
Η μία ή άλλη μορφή βραχυθεραπείας ίσως μπορεί να συνδυαστούν με την εξωτερική ακτινοβολία (IMRT/VMAT συν IGRT) σε όσους έχουν ΜΗ ευνοϊκό μέτριου κινδύνου καρκίνο και σε υψηλού κινδύνου καρκίνο.
ΠΡΟΛΗΠΤΙΚΗ ΑΚΤΙΝΟΒΟΛΙΑ ΟΛΟΚΛΗΡΗΣ ΤΗΣ ΠΥΕΛΟΥ ?
Ακτινοβολία θα διενεργηθεί σε ολόκληρη της πύελο ώστε να καταστραφούν και καρκινικά κύτταρα που ενδεχομένως μεταφέρθηκαν στους αντίστοιχους λεμφαδένες ΜΟΝΟ στην περίπτωση ΥΨΗΛΟΥ κινδύνου καρκίνο και εφόσον η πιθανότητα αυτή ξεπερνά το 20% με τον τύπο Roach. = 2/3 x PSA + ([Gleason-6] x 10).
Πιο πρόσφατος υπολογιστής είναι ο Yale formula, όπου όριο ακτινοβόλησης ολόκληρης της πυέλου θεωρείται η πιθανότητα >15%.
https://www.evidencio.com/models/show/699
Στον υψηλού κινδύνου ίσως μπορεί να ακτινοβοληθούν και οι πυελικοί λεμφαδένες (whole pelvic RT ή WPRT) παρ’ όλο δεν υπάρχει όφελος στη συνολική θνητότητα και είναι αυξημένη η μακροχρόνια τοξικότητα (late GU > 2 effects) κυρίως στην ουροδόχο κύστη (17.7% vs 7.5% στην ακτινοβόληση μόνο του προστάτη) – AUA 2022
Αντίθετα σε όσους είναι χαμηλού ή μέτριου κινδύνου και επιλέξουν ακτινοθεραπεία, ΔΕΝ ακτινοβολούνται οι πυελικοί λεμφαδένες.
ΘΕΡΑΠΕΙΑ ΣΤΕΡΗΣΗΣ ΑΝΔΡΟΓΟΝΩΝ (ADT – ANDROGEN DEPRIVATION THERAPY)
Ο πολλαπλασιασμός των καρκινικών κυττάρων του καρκίνου του προστάτη ευνοείται από τα ανδρογόνα. Έτσι σε μερικές περιπτώσεις χορηγούνται φάρμακα ώστε να μην υπάρχουν ή /και να μην δρουν τα Ανδρογόνα (η Τεστοστερόνη που παράγεται από τους όρχεις) στα κύτταρα.
Η θεραπεία θεωρείται αποτελεσματική αν η Τεστοστερόνη μειωθεί σε λιγότερο από 20 ng/dL (< 0.7 nmol/L).
>> Η χορήγηση “Αντιανδρογόνων” (ADT) γίνεται σχεδόν πάντα σε συνδυασμό με ακτινοθεραπεία.
Μπορεί να χορηγηθεί αγωνιστής Ωχρινοτρόπου Ορμόνης (LHRH) μόνος του ή LHRH ανταγωνιστής μόνος του ή συνδυασμός LHRH αγωνιστή με αποκλειστή των υποδοχέων των Ανδρογόνων (ο τελευταίος συνήθως χορηγείται για 1 μήνα).
Αυτά μπορεί να χορηγηθούν πριν και ταυτόχρονα ή ταυτόχρονα και μετά τις ακτινοθεραπείες, όμως ίσως είναι καλύτερη η χορήγηση τους ταυτόχρονα και μετά τις ακτινοθεραπείες.
Σε όσους είναι υψηλού κινδύνου με συμπτώματα και μειωμένο προσδόκιμο ζωής ίσως χορηγηθούν σαν Μονοθεραπεία “Aντιανδρογόνα” (ADT).
Παρενέργειες από τα “Aντιανδρογόνα” (ADT): Απώλεια στύσης, κατάγματα λόγω οστεοπόρωσης, απώλεια μυϊκής μάζας, αύξηση σωματικού βάρους, κατάθλιψη κλπ.
>> Οι αγωνιστές LHRH προκαλούν σε δεύτερη φάση τη ΜΗ παραγωγή Ωχρινοτρόπου Ορμόνης, που δρα στους όρχεις για να παραχθούν Ανδρογόνα.
Αυτά είναι Leuprolide (Lupron, Elityran), Goserelin (Zoladex), Triptorelin (Trelstar, Arvekap), Ηistrelin (Vantas).
>> LHRH ανταγωνιστές είναι τα Degarelix (Firmagon) σε ένεση, Relugolix (Orgovyx) από το στόμα. Το τελευταίο ίσως είναι καλύτερο από την ένεση Elityran.
>> Οι αποκλειστές των υποδοχέων Ανδρογόνων στο σώμα είναι οι πρώτης γενιάς, μη στεροειδείς:
Flutamide (Eulexin), Bicalutamide (Casodex), και Nilutamide (Nilandron, Anandron),
και οι δεύτερης γενιάς (ARPis):
Enzalutamide (Xtandi), Apalutamide (Erleada), και Darolutamide (Nubeqa). Οι δεύτερης γενιάς χρησιμοποιούνται κυρίως σε υψηλό κίνδυνο μεταστάσεων, σε castration-resistance καρκίνο (CRPC).
ΑΙΤΙΕΣ ΤΩΝ ΚΑΡΚΙΝΩΝ
>> Οι Καρκίνοι προκαλούνται από διάφορες αιτίες που έχουν σαν αποτέλεσμα μεταλλάξεις σε συγκεκριμένα γονίδια που ευνοούν τον καρκίνο ή/και επιγενετικές αλλαγές σ’ αυτά τα γονίδια.
>> Οι μεταλλάξεις ή/και οι επιγενετικές αλλαγές, γίνονται σε τρία είδη γονιδίων:
α) στα ογκογονίδια αν η μετάλλαξη αυξάνει τη δράση τους, β) σε γονίδια που καταπιέζουν τη δημιουργία όγκων αν η μετάλλαξη μειώνει τη δράση τους και γ) σε γονίδια που διορθώνουν το DNA αν η μετάλλαξη μειώνει τη δράση τους.
(Οι επιγενετικές αλλαγές ενεργοποιούν ή απενεργοποιούν γονίδια που σχετίζονται με τον καρκίνο μέσω ενεργοποίησης ή απενεργοποίησης της δημιουργίας mRNA από αυτά)
> Η συσσώρευση μεταλλάξεων ή/και επιγενετικών αλλαγών διαρκεί συνήθως χρόνια ή δεκαετίες ώστε να δημιουργηθεί το πρώτο καρκινικό κύτταρο.
>>> Το πρώτο καρκινικό κύτταρο έχει καταφέρει να ξεφύγει διαδοχικά από όλους τους ελέγχους και επιδιορθώσεις του DNA (κατά τις κυτταρικές διαιρέσεις και τις βλάβες του από άλλους παράγοντες), από τον προγραμματισμένο θάνατο (απόπτωση) όσων κυττάρων δημιουργούνται με ελαττωματικό DNA και επιπλέον καταφέρνει να “κρυφτεί” από το ανοσοποιητικό σύστημα για να μην εξοντωθεί.
>> Στη συνέχεια αυτό βρίσκει τρόπο να διαιρείται χωρίς ελέγχους, αμέτρητες φορές (με διατήρηση του μήκος των τελομερών στο ελάχιστο δυνατό).
Πιο πάνω φαίνονται καρκινικά κύτταρα του προστάτη
ΕΝΔΕΙΚΤΙΚΗ ΒΙΒΛΙΟΓΡΑΦΙΑ
https://evidence.nejm.org/doi/10.1056/EVIDoa2300018
https://www.cancer.gov/types/prostate/hp/prostate-treatment-pdq#_69
https://ascopubs.org/doi/abs/10.1200/JCO.2018.36.6_suppl.130
https://www.nejm.org/doi/full/10.1056/NEJMoa2214122
https://pubmed.ncbi.nlm.nih.gov/33497252/
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9902004/
https://www.cancer.gov/types/prostate/hp/prostate-treatment-pdq#_69
https://www.sciencedirect.com/science/article/abs/pii/S0167814022001153
https://www.nice.org.uk/guidance/ng131/chapter/recommendations
https://ascopubs.org/doi/10.1200/JCO.20.03282
https://ascopubs.org/doi/10.1200/JCO.23.00617
https://www.rtog.org/News/NRG-Oncology-Trial-Does-Not-Improve-Overall-Survival