Η ΔΙΑΤΑΤΙΚΗ ΜΥΟΚΑΡΔΙΟΠΑΘΕΙΑ
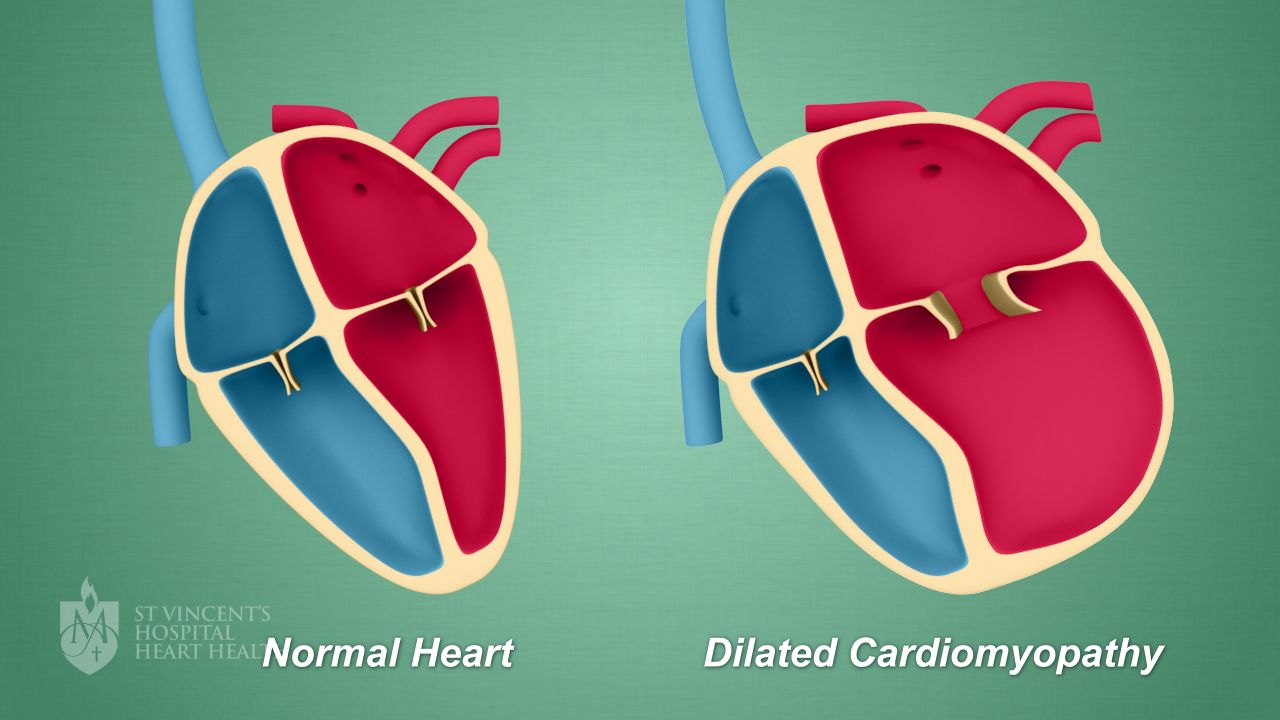
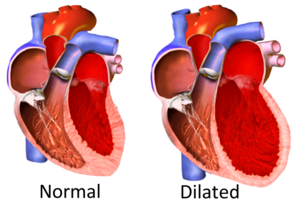
Η Διατατική μυοκαρδιοπάθεια (Dilated cardiomyopathy ή DCM) είναι ένας όρος που χρησιμοποιείται για πολλές διαφορετικές αιτίες που προκαλούν πρωτοπαθή βλάβη του καρδιακού μυ και έχουν τελικό αποτέλεσμα τη διάταση της αριστερής κοιλίας (ή και των δυο κοιλιών) και καρδιακή ανεπάρκεια με μειωμένη σύσπαση του καρδιακού μυ.
(Πρωτοπαθής βλάβη του καρδιακού μυ = ΔΕΝ οφείλεται σε στεφανιαία νόσο, βαλβιδοπάθεια, υπερτασική ή συγγενή καρδιοπάθεια)
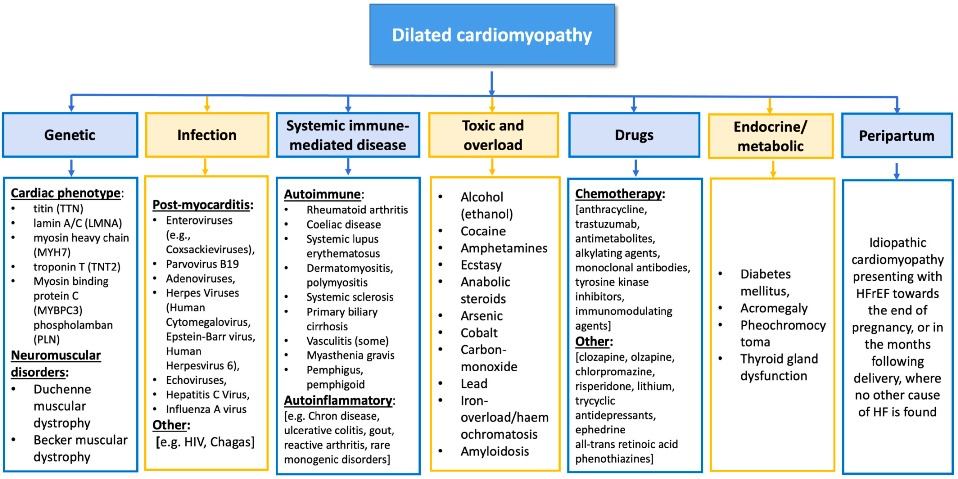
Η Διατατική μυοκαρδιοπάθεια οφείλεται κυρίως σε γονιδιακές οικογενείς (περίπου 30% των περιπτώσεων) ή σποραδικές μεταλλάξεις, σε περιβαλλοντικούς παράγοντες (π.χ. κατανάλωση αλκοόλ, μυοκαρδίτιδα από ίωση κλπ.), σε συστηματικές παθήσεις (π.χ. Υποθυρεοειδισμός και Υπερθυρεοειδισμός, Ρευματοειδής αρθρίτιδα κλπ.), και σε άγνωστες ακόμη αιτίες, οπότε αυτή λέγεται ιδιοπαθής. (Δες πιο κάτω)
Η Διατατική μυοκαρδιοπάθεια αυξάνει τον κίνδυνο του αιφνιδίου θανάτου από επικίνδυνες κοιλιακές αρρυθμίες και καταλήγει τελικά σε σφαιρική διάταση της αριστερής (ή και των δυο κοιλιών) με λέπτυνση του τοιχώματος, μειωμένη συσπαστικότητα και συμπτώματα καρδιακής ανεπάρκειας.
Η Διατατική μυοκαρδιοπάθεια εμφανίζεται σε περίπου 1 ανά 250 – 500 ανθρώπους, με τα συμπτώματα (επικίνδυνες κοιλιακές αρρυθμίες, δύσπνοια, εξάντληση) να πρωτοεμφανίζονται κυρίως σε ηλικίες 20-60 ετών και έχει διαφορετικό ρυθμό επιδείνωσης ανάλογα με την αιτιολογία της.
(Στα παιδιά εμφανίζεται περίπου 1 περίπτωση ανά 200.000/έτος)
Η πρωτοπαθής βλάβη του καρδιακού μυ οφείλεται σε βλάβη των μυοκαρδιακών κυττάρων που αφορούν τις πρωτεΐνες που σχετίζονται με τη σύσπαση (και τη χάλαση) της καρδιάς και τη δομική ακεραιότητα των κοιλιών.
ΣΥΜΠΤΩΜΑΤΑ
Τα συμπτώματα της Διατατικής μυοκαρδιοπάθειας είναι τα συμπτώματα της καρδιακής ανεπάρκειας: Δύσπνοια, εξάντληση, βήχας, οίδημα, πόνος στο θώρακα κλπ. (Αυτά μπορεί να εμφανιστούν ξαφνικά ή να είναι χρόνια.)
Επίσης μπορεί να υπάρχει αίσθημα παλμών από τις αρρυθμίες, συγκοπτικό επεισόδιο και αιφνίδιος θάνατος.
Η ΑΙΤΙΟΛΟΓΙΑ ΤΗΣ ΔΙΑΤΑΤΙΚΗΣ ΜΥΟΚΑΡΔΙΟΠΑΘΕΙΑΣ
Η Διατατική μυοκαρδιοπάθεια είναι το τελικό εμφανές αποτέλεσμα γονιδιακών οικογενών ή σποραδικών μεταλλάξεων (προκαλούν κατασκευαστικές, μεταβολικές και λειτουργικές δυσλειτουργίες), περιβαλλοντικών παραγόντων, συστηματικών παθήσεων, ταχυμυοπάθειας και άγνωστων ακόμη αιτίων, οπότε αυτή λέγεται ιδιοπαθής.
Πολλές φορές η Διατατική μυοκαρδιοπάθεια οφείλεται σε συνδυασμό γενετικής προδιάθεσης και επιγενετικών περιβαλλοντικών παραγόντων.
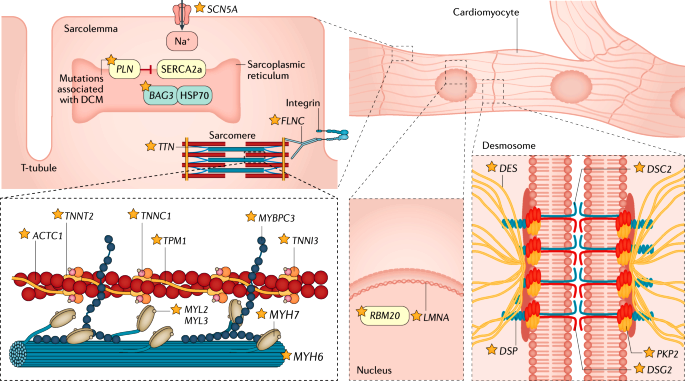
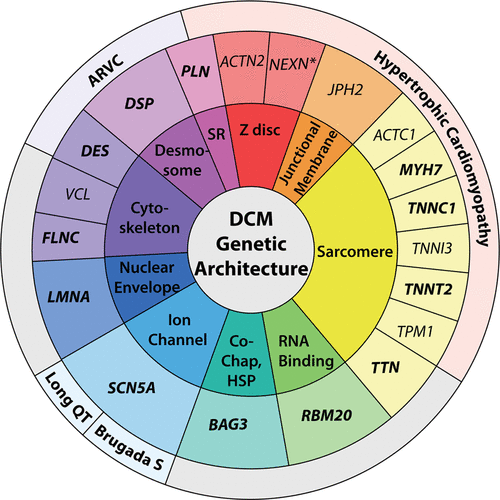
>> Οι μεταλλάξεις αφορούν κυρίως σε γονίδια των σαρκομεριδίων (π.χ. TTN, MYH7), του κυτταροσκελετού (πχ. FLNC), των δεσμοσωμάτων (DSP), της εσωτερικής πυρηνικής μεμβράνης (LMNA), των διαύλων Νατρίου SCN5A κλπ.
Οι συχνότερες μεταλλάξεις γονιδίων που την προκαλούν είναι του γονιδίου TTN σε ποσοστό σχεδόν 20%, του γονιδίου LMNA σε ποσοστό 5% (αυτό προκαλεί συχνά αρρυθμίες) και του γονιδίου MYH7 σε ποσοστό 3% (αυτό προκαλεί και υπερτροφική μυοκαρδιοπάθεια). (Δες πιο κάτω)
https://www.ahajournals.org/doi/10.1161/CIRCULATIONAHA.120.053033
>> Οι περιβαλλοντικοί παράγοντες είναι λοιμώξεις – μυοκαρδίτιδες,** τοξικές ουσίες π.χ. αλκοόλ, κοκαΐνη, αμφεταμίνες, άλλα ναρκωτικά, βαρέα μέταλλα (π.χ. Κοβάλτιο, Υδράργυρος, Μόλυβδος), Μονοξείδιο του Άνθρακα, φάρμακα (π.χ. αντικαρκινικά όπως οι Ανθρακυκλίνες όπως η doxorubicin, η 5-fluorouracil, ψυχιατρικά π.χ. Λίθιο κλπ.), ελλείψεις στη διατροφή (π.χ. στη βιταμίνη Β1 ή Θειαμίνη, στην Καρνιτίνη, στο Σελήνιο) κλπ.
[** Διάφοροι ιοί, με συχνότερους τους εντεροϊούς (π.χ. ιός Coxsackie Β2), αποτελούν συχνή αιτία της διατατικής μυοκαρδιοπάθειας. Όμως υπάρχουν και άλλοι μικροοργανισμοί που την προκαλούν π.χ. το παράσιτο Τρυπανόσωμα cruzi (νόσος Chaga) κλπ.]
>> Οι συστηματικές παθήσεις είναι ενδοκρινολογικές παθήσεις (π.χ. νόσος του Cushing, Φαιοχρωμοκύττωμα, Υπόθυρεοειδισμός, Υπερθυρεοειδισμός κλπ.), αυτοάνοσες παθήσεις (π.χ. ρευματοειδής αρθρίτιδα, νεανικός διαβήτης, θυρεοειδοπάθειες κλπ.), νευρομυϊκές νόσοι κλπ.
>> Η μυοκαρδιοπάθεια από επιμένουσες ταχυκαρδίες – ταχυαρρυθμίες (ή ταχυμυοπάθεια ή TIC ή AiCM) είναι μια δυνητικά αναστρέψιμη αιτία Διατατικής μυοκαρδιοπάθειας. Αυτή μπορεί να γίνει από επιμένουσα Ταχυκαρδία από οποιαδήποτε περιοχή της καρδιάς, από επιμένουσα γρήγορη κολπική μαρμαρυγή και από συχνές έκτακτες κοιλιακές συστολές, πάνω από 10.000/ 24ωρο (ή πάνω από το 10% των συστολών του 24ώρου).
https://www.nature.com/articles/s41572-019-0084-1
Η ΔΙΑΓΝΩΣΗ
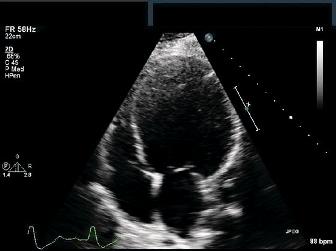
Η διάγνωση της βασίζεται κυρίως στο Ιστορικό (οικογενειακό 3 γενεών και ατομικό), στη φυσική εξέταση, στο Υπερηχοκαρδιογράφημα και σε γονιδιακό έλεγχο (δες πιο κάτω) με next-generation sequencing (NGS).
Το Υπερηχοκαρδιογράφημα θα δείξει τη σφαιρική διάταση της αριστερής κοιλίας και τη μείωση του κλάσματος εξωθήσεως κάτω από 45%.
[Κλάσμα εξωθήσεως ή Ejection Fraction (EF) ονομάζεται το πόσο ποσοστό από το αίμα που μπήκε στην αριστερή κοιλία (κατά τη διαστολή της), εκτοξεύθηκε στην αορτή (κατά τη συστολή της). Αυτό φυσιολογικά πρέπει να είναι μεγαλύτερο από 50%.]
Άλλες εξετάσεις που θα χρειαστούν είναι το ΗΚΓφημα, βιοχημικός έλεγχος (π.χ. BNP ή pro-NT-BNP κλπ.), το συνεχόμενο ΗΚΓφημα Holter (για ανεύρεση επικίνδυνων αρρυθμιών) και η καρδιακή μαγνητική τομογραφία (CMR) με σκιαγραφικό και τεχνική καθυστερημένης ενίσχυσης Γαδολινίου (Late Gadolinium Enhancement LGE) όπου ανιχνεύεται ινώδης ιστός περίπου στο 30% των ασθενών.
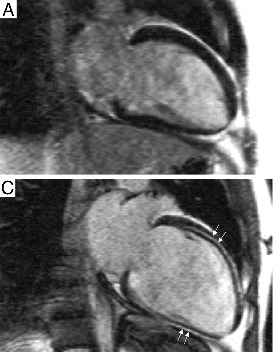
Στις πιο πάνω καρδιακές μαγνητικές τομογραφίες ανθρώπων με Διατατική μυοκαρδιοπάθεια, στην Α εικόνα δεν υπάρχει καθυστερημένη ενίσχυση Γαδολινίου (LGE -), ενώ στη C εικόνα φαίνεται καθυστερημένη ενίσχυση Γαδολινίου (LGE +), δηλαδή ίνωση, στο μέσον του μυϊκού τοιχώματος.
Επιπλέον σε όσους είναι > 35 ετών θα χρειαστεί να αποκλειστεί η στεφανιαία νόσος κυρίως με αναίμακτη στεφανιογραφία.
Αν υπάρχει υποψία φλεγμονής – μυοκαρδίτιδας θα γίνει και ενδομυοκαρδιακή βιοψία για ανεύρεση του υπεύθυνου αιτίου.
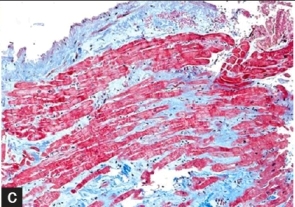
[Οι ιστολογικές αλλοιώσεις που παρατηρούνται στη Διατατική μυοκαρδιοπάθεια είναι μη ειδικές και συνήθως είναι η εύρεση κυττάρων του ανοσοποιητικού που επιστρατεύτηκαν για επιδιόρθωση της βλάβης – φλεγμονής, η απώλεια της παράλληλης διάταξης των μυοκυττάρων, η εκφύλιση και η νέκρωση τους, η εναπόθεση κολλαγόνου και ινώδους ιστού ανάμεσα στα κύτταρα]
https://pubmed.ncbi.nlm.nih.gov/29323059/
Η ΠΡΟΓΝΩΣΗ
Η πρόγνωση της Διατατικής μυοκαρδιοπάθειας εξαρτάται από την αιτιολογία της, από το πόσο μειωμένο είναι το κλάσμα εξωθήσεως της, από την ύπαρξη και έκταση του ινώδη ιστού, από τη συνύπαρξη και άλλων παθήσεων κλπ.
Η πρόγνωση για τους ανθρώπους με καρδιακή ανεπάρκεια μπορεί να υπολογιστεί και στο διαδίκτυο με τα σκορ της Βαρκελώνης και του Σιάτλ.
http://ww2.bcnbiohfcalculator.org/web/calculations
https://depts.washington.edu/shfm/?width=1280&height=800
Η 5ετής θνητότητα από αυτήν ήταν 50%, μειώθηκε όμως στο 20-25% σήμερα με τις τελευταίες προόδους τις Ιατρικής.
Η ΘΕΡΑΠΕΙΑ
>> Η θεραπεία της Διατατικής μυοκαρδιοπάθειας είναι στην ουσία η θεραπεία της χρόνιας καρδιακής ανεπάρκειας.
>> Όμως υπάρχουν και περιπτώσεις που μπορεί να αποφευχθεί η Διατατική μυοκαρδιοπάθεια (π.χ. κατανάλωση αλκοόλ, ναρκωτικά, με αποφυγή ορισμένων φαρμάκων π.χ. για τον καρκίνο κλπ.) ή να καταπολεμηθεί η αιτία (π.χ. με φάρμακα κατά των ιών) ή να χορηγηθεί η ουσία που η έλλειψη της την προκάλεσε (π.χ. βιταμίνη Β1).
>> Επιπλέον πρέπει το σωματικό βάρος να μην υπερβαίνει το προβλεπόμενο από το ύψος (ύψος, σε μέτρα, στο τετράγωνο επί 25), και να γίνεται κάποια ελαφρά άσκηση όπως το βάδισμα (π.χ. > 15 χιλιόμετρα τη βδομάδα).
>> Επίσης πρέπει να προληφθούν οι κοιλιακές αρρυθμίες που είναι επικίνδυνες για τη ζωή.
Αυτές εμφανίζονται στους ανθρώπους με Διατατική μυοκαρδιοπάθεια σε ποσοστό 4-5% ανά έτος και μπορεί σε ορισμένες περιπτώσεις η προληπτική τοποθέτηση αυτόματου εμφυτεύσιμου απινιδωτή (ICD) ή αμφικοιλιακού βηματοδότη με ICD (CRT-D) να τις σταματήσει πριν να συμβεί αιφνίδιος θάνατος.
Πάντως με τη σύγχρονη φαρμακευτική θεραπεία φαίνεται ότι σε όσους έχουν καρδιακή ανεπάρκεια που ΔΕΝ οφείλεται σε ισχαιμία, η τοποθέτηση ICD, ΔΕΝ μειώνει τους ΣΥΝΟΛΙΚΟΥΣ θανάτους, παρ’ όλο που ο κίνδυνος αιφνιδίου θανάτου μειώνεται στο 50%.
Με μείωση των συνολικών θανάτων με ICD σε αυτή την περίπτωση (NICM), ωφελούνται μόνο οι νεώτεροι των 59 χρονών (συνολικοί θάνατοι 10% vs 19%), όσοι έχουν ίνωση στο μέσο τοίχωμα της αριστερής κοιλίας (ΜWF) και γενικά όσο περισσότερη η ίνωση, τόσο αυξάνεται ο κίνδυνος αιφνιδίου θανάτου.
# Ίσως στο μέλλον να χρησιμοποιείται περισσότερο η ύπαρξη και έκταση της ίνωσης (LGE) για την εύρεση όσων κινδυνεύουν περισσότερο με αιφνίδιο θάνατο, άσχετα με τη μείωση του κλάσματος εξωθήσεως.
https://pubmed.ncbi.nlm.nih.gov/28017348/
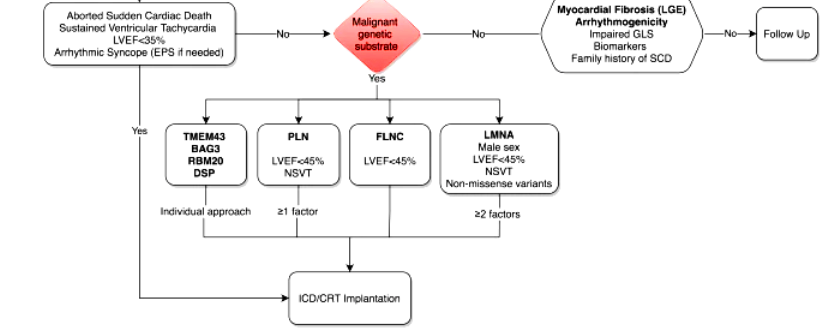
# Αν έχει συμβεί ήδη επιμένουσα κοιλιακή ταχυκαρδία ή κοιλιακή μαρμαρυγή και ο ασθενής επιβίωσε, τότε χρειάζεται να τοποθετηθεί ICD οπωσδήποτε (δευτερογενής πρόληψη), εφ’ όσον αναμένεται αξιοπρεπής ζωή πάνω από 1 χρόνο.
# Πρωτογενώς σύμφωνα με τις υπάρχουσες οδηγίες ο ICD τοποθετείται σε ανθρώπους με Διατατική μυοκαρδιοπάθεια αν έχει συμπτώματα σταδίου ΙΙ ή ΙΙΙ (κατά NYHA) και κλάσμα εξωθήσεως < 35% (εφ’ όσον έχει προηγηθεί βέλτιστη φαρμακευτική θεραπεία τουλάχιστον για 3 μήνες και εφ’ όσον αναμένεται να ζήσει αξιοπρεπώς περισσότερο από 1 χρόνο).
# Όμως αν υπάρχουν ορισμένες μεταλλάξεις σε γονίδια που προκαλούν συχνά επικίνδυνες κοιλιακές ταχυαρρυθμίες πριν να μειωθεί το κλάσμα εξωθήσεως κάτω από 35%, μπορεί να τοποθετηθεί σε ύπαρξη τους ICD ακόμη και με ψηλότερο κλάσμα εξωθήσεως.
Αυτές οι συγκεκριμένες μεταλλάξεις αφορούν τα γονίδια LMNA, DSP, PLN, FLNC και το SCN5A. (Επίσης τα γονίδια BAG3, TMEM43 και RBM20).
ΠΕΡΙΣΣΟΤΕΡΑ ΓΙΑ ΤΑ ΜΕΤΑΛΛΑΓΜΕΝΑ ΓΟΝΙΔΙΑ ΣΤΗΝ ΔΙΑΤΑΤΙΚΗ ΜΥΟΚΑΡΔΙΟΠΑΘΕΙΑ
> Γονιδιακός έλεγχος θα χρειαστεί σε όλες τις περιπτώσεις με Διατατική μυοκαρδιοπάθεια.
Η μη ανεύρεση μεταλλαγμένου γονιδίου δεν αποκλείει την ύπαρξη άλλου, άγνωστου ακόμη μεταλλαγμένου γονιδίου.
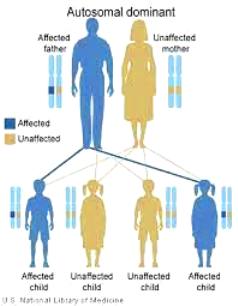
Η κληρονομικότητα της DCM είναι σχεδόν πάντα αυτοσωματική επικρατούσα με μειωμένη διεισδυτικότητα (δεν υπάρχει σε όλους τους απογόνους η νόσος).
Η μειωμένη διεισδυτικότητα οφείλεται σε επιγενετικούς παράγοντες και πιθανόν σε άλλα τροποποιητικά γονίδια.
> Αν βρεθεί μεταλλαγμένο γονίδιο, θα διενεργηθεί γονιδιακός έλεγχος και στους συγγενείς ακόμη και αν είναι ασυμπτωματικοί, ώστε είτε να τεθούν υπό στενή παρακολούθηση αν βρεθεί και σε αυτούς το μεταλλαγμένο γονίδιο είτε να απαλλαγούν από μελλοντική παρακολούθηση αν δεν βρεθεί και σε αυτούς μεταλλαγμένο γονίδιο.
Το γονίδιο που έχει μεταλλαχθεί, συνηθέστερα σε κάποιο πρόγονο, αφορά στη δημιουργία κάποιας παθολογικής ή μειωμένης πρωτεΐνης.
Οι μεταλλάξεις αφορούν κυρίως σε γονίδια των σαρκομεριδίων (π.χ. TTN, MYH7), του κυτταροσκελετού (πχ. FLNC), των δεσμοσωμάτων (DSP), της εσωτερικής πυρηνικής μεμβράνης (LMNA), των διαύλων Νατρίου SCN5A κλπ.
Επίσης η Μυοκαρδιοπάθεια πριν και μετά τον τοκετό (PPCM) θεωρείται ότι έχει και γενετικό υπόβαθρο.
Πάνω από 60 γονίδια έχουν ενοχοποιηθεί ότι προκαλούν Διατατική μυοκαρδιοπάθεια (DCM). Όμως πρόσφατα μια επιτροπή ειδικών έλεγξε πια γονίδια πραγματικά προκαλούν DCM και κατέληξε στο συμπέρασμα ότι μόνο 19 από αυτά (από 10 διαφορετικές οντότητες) σχετίζονται με αυτήν αξιόπιστα.
>> Οι συχνότερες μεταλλάξεις γονιδίων που την προκαλούν είναι του γονιδίου TTN σε ποσοστό περίπου 20%, του γονιδίου LMNA σε ποσοστό περίπου 5% (αυτό προκαλεί συχνά αρρυθμίες) και του γονιδίου MYH7 σε ποσοστό περίπου 3% (αυτό προκαλεί και υπερτροφική μυοκαρδιοπάθεια).
Και οι 3 αυτές μεταλλάξεις μεταφέρονται με αυτοσωματική επικρατούσα κληρονομικότητα (το 50% των απογόνων μπορεί να εκδηλώσει τη νόσο).
Άλλα γονίδια που σίγουρα προκαλούν Διατατική μυοκαρδιοπάθεια είναι τα: BAG3, DES, FLNC, PLN, RBM20, SCN5A, TNNC1, TNNT2, DSP και με μέτρια σιγουριά είναι τα γονίδια ACTC1, ACTN2, JPH2, NEXN, TNNI3, TPM1, VCL.
Υπ’ όψιν ότι πέρα από αυτά τα 19 γονίδια που γνωρίζουμε σήμερα ότι σίγουρα προκαλούν Διατατική μυοκαρδιοπάθεια υπάρχουν και άλλα άγνωστα ακόμη γονίδια.
https://www.ahajournals.org/doi/10.1161/CIRCULATIONAHA.120.053033
Αν μεταλλαχθούν, πολλά από αυτά προκαλούν και υπερτροφική μυοκαρδιοπάθεια, τα 3 από αυτά προκαλούν και αρρυθμιογόνο μυοκαρδιοπάθεια και το γονίδιο SCN5A που σχετίζεται με τον δίαυλο ιόντων Νατρίου SCN5A, προκαλεί και σύνδρομο Brugada (μείωση της λειτουργικότητας του διαύλου) ή σύνδρομο μακρού QT (αύξηση της λειτουργικότητας του διαύλου).
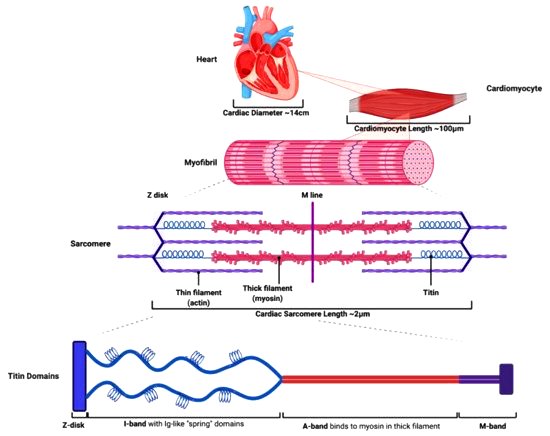
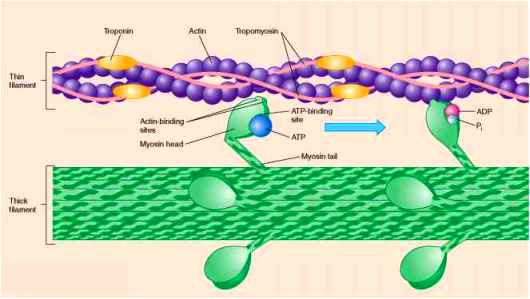
Το γονίδιο TTN δίνει την οδηγία για την κατασκευή της πρωτεΐνης Τιτίνης*, το γονίδιο LMNA δίνει οδηγία για την κατασκευή των πρωτεϊνών Λαμινών** A/C και το γονίδιο MYH7 δίνει οδηγία για την κατασκευή της πρωτεΐνης Μυοσίνης*** του σαρκομεριδίου και σχετίζεται με την ομαλή σύνδεση – αποσύνδεση της Μυοσίνης με την Ακτίνη.
>> Οι μεταλλάξεις που προκαλούν συχνότερα κοιλιακές ταχυαρρυθμίες και κίνδυνο αιφνιδίου θανάτου, αφορούν κυρίως τα γονίδια LMNA**, DSP****, PLN*****, FLNC****** και το γονίδιο SCN5A. Επίσης τα γονίδια BAG3, TMEM43 και RBM20.
[* Η πρωτεΐνη Τιτίνη παρεμβάλλεται ανάμεσα στη Μυοσίνη και τους δίσκους Ζ. Αυτή είναι ένα τεράστιο μοριακό “ελατήριο” που αποτελείται από > 30.000 αμινοξέα και σχετίζεται με ελαστικές και ιξώδεις ιδιότητες του σαρκομεριδίου (η μικρότερη μονάδα σύσπασης των μυοκυττάρων).
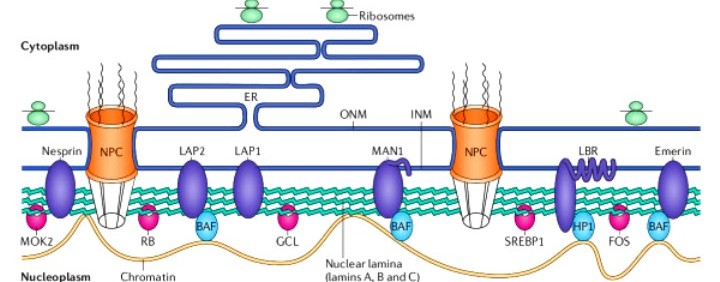
** Μεταλλάξεις του γονιδίου LMNA (που δημιουργεί τη Λαμίνη Α/C) προκαλούν Διατατική μυοκαρδιοπάθεια, μυϊκές δυστροφίες και νευροπάθειες.
Η Διατατική μυοκαρδιοπάθεια από μετάλλαξη στο γονίδιο LMNA παρουσιάζει συχνά κολποκοιλιακό αποκλεισμό, κολπική μαρμαρυγή και κοιλιακές ταχυαρρυθμίες με πιθανό αιφνίδιο θάνατο.
Οι πρωτεΐνες Λαμίνες (Β και Α με ισομορφές Α/C) είναι κυρίως δομικές πρωτεΐνες για την εσωτερική πυρηνική μεμβράνη και τον πυρήνα.
Επίσης βοηθούν στην οργάνωση και επιδιόρθωση του DNA, στην δημιουργία του mRNA από το DNA (transcription) και στην ενεργοποίηση (έκφραση) ορισμένων γονιδίων.
Επιπλέον βοηθούν στη μίτωση και τον προγραμματισμένο θάνατο του κυττάρου (απόπτωση).
*** Οι Κεφαλές της Μυοσίνης τραβούν τα ινίδια της Ακτίνης προς το κέντρο και αρχίζει η σύσπαση του σαρκομεριδίου.
**** Το μεταλλαγμένο γονίδιο DSP (Δεσμοπλακίνη) μπορεί να προκαλέσει και καθ’ υπεροχήν αριστερή αρρυθμιογόνο μυοκαρδιοπάθεια (π.χ. το σύνδρομο Carvajal). Σ’ αυτή τη ματάλλαξη βρίσκεται καθυστερημένη ενίσχυση γαδολινίου (LGE) στο κοιλιακό τοίχωμα, πριν να δημιουργηθεί τελικά η καρδιακή ανεπάρκεια.
***** Το γονίδιο PLN εκφράζει την πρωτεΐνη Φωσφολαμπάνη που βρίσκεται στη μεμβράνη του σαρκοπλασματικού δικτύου και έχει κεντρικό ρόλο στη διαχείριση του Ασβεστίου, ώστε να ρυθμίζεται η σύσπαση και η χάλαση της καρδιάς.
****** Το γονίδιο FLNC εκφράζει τη δομική πρωτεΐνη Φιλαμίνη C. Αυτή συνδέεται με την Ακτίνη, τον Ζ δίσκο των σαρκομεριδίων, την κυτταρική μεμβράνη και τον παρεμβαλλόμενο δίσκο.
Έτσι η Φιλαμίνη C πέρα από τη μηχανική σταθερότητα που προσφέρει, φαίνεται ότι χρησιμεύει και σαν μηχανικός αισθητήρας για τη συγχρονισμένη σύσπαση γειτονικών σαρκομεριδίων και κυττάρων του μυοκαρδίου.]
ΕΝΔΕΙΚΤΙΚΗ ΒΙΒΛΙΟΓΡΑΦΙΑ
https://link.springer.com/article/10.1007/s10741-021-10139-0
https://www.heartrhythmjournal.com/article/S1547-5271(19)30438-2/fulltext
https://www.ahajournals.org/doi/10.1161/CIRCULATIONAHA.120.053033
https://academic.oup.com/eurheartj/article-abstract/42/24/2384/6307392
https://onlinelibrary.wiley.com/doi/10.1002/ehf2.12809\
https://pubmed.ncbi.nlm.nih.gov/32853471/
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7956169/
https://onlinelibrary.wiley.com/doi/full/10.1111/joim.12944
https://www.nature.com/articles/s41572-019-0084-1
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7216277/
https://pubmed.ncbi.nlm.nih.gov/34174465/
https://www.mdpi.com/2077-0383/10/4/577/htm
https://www.jacc.org/doi/full/10.1016/j.jacc.2016.09.927
https://medlineplus.gov/genetics/gene/ttn/