ΤΑ ΣΥΜΠΛΗΡΩΜΑΤΙΚΑ (ANTI-SENSE) ΟΛΙΓΟΝΟΥΚΛΕΟΤΙΔΙΑ (ASO) ΚΑΙ Η ΜΕΙΩΣΗ ΤΩΝ ΑΝΕΠΙΘΥΜΗΤΩΝ ΠΡΩΤΕΙΝΩΝ
Ενημερώθηκε στις 10/4/2017
Τα τελευταία χρόνια γίνεται μια επανάσταση όπου ο άνθρωπος παρεμβαίνει στη φύση σταματώντας τη ”μετάφραση” ορισμένων ανεπιθύμητων πρωτεϊνών από το DNA.
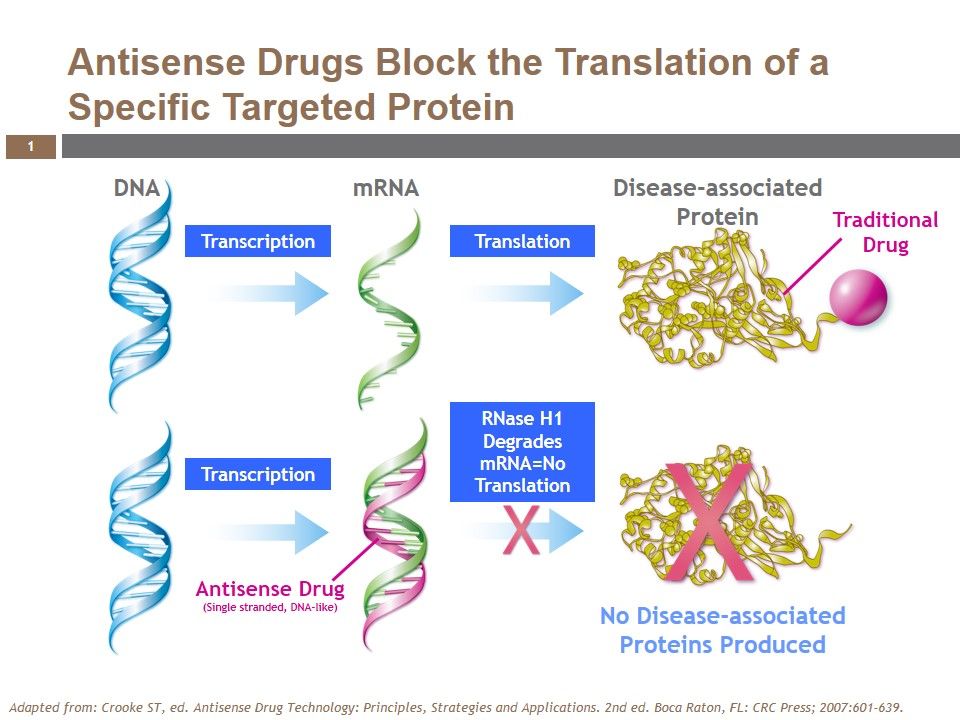
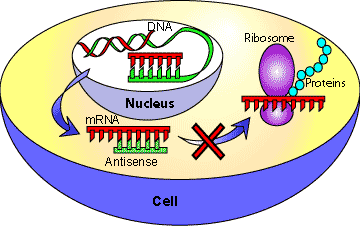
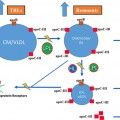
Τα φάρμακα συμπληρωματικά ολιγονουκλεοτίδια (anti-sense oligonucleotide- ASO), ενώνονται με το m- RNA και σταματούν την μετάφραση- παραγωγή των αντίστοιχων πρωτεϊνών στα ριβοσώματα των κυττάρων.
ΛΙΓΑ ΓΙΑ ΤΟΝ ΓΕΝΕΤΙΚΟ ΚΩΔΙΚΑ
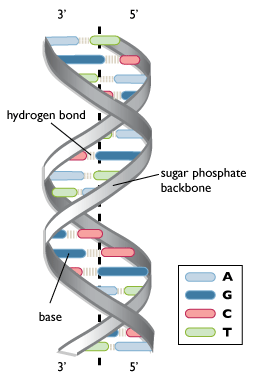
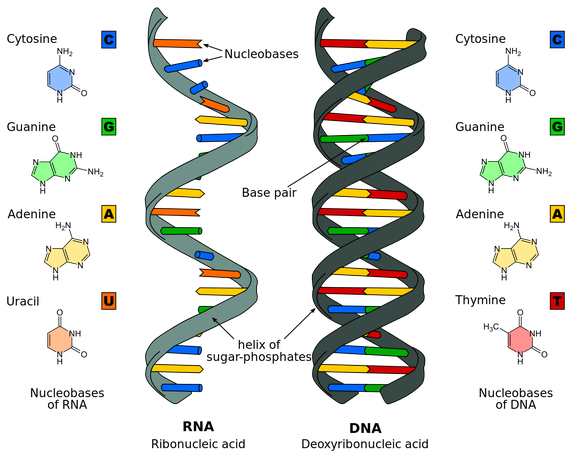
Το DNA που μεταφέρει τον γενετικό μας κώδικα βρίσκεται στον πυρήνα των κυττάρων και αποτελείται από διπλή έλικα με διαδοχικά νουκλεοτίδια που τα απαρτίζουν 4 βάσεις (οι πουρίνες Αdenine- Α και Guanine-G και οι πυριμιδίνες Thymine-T και Cytosine-C, ) σε σειρά όπως περιγράφηκε από τους Watson–Crick.
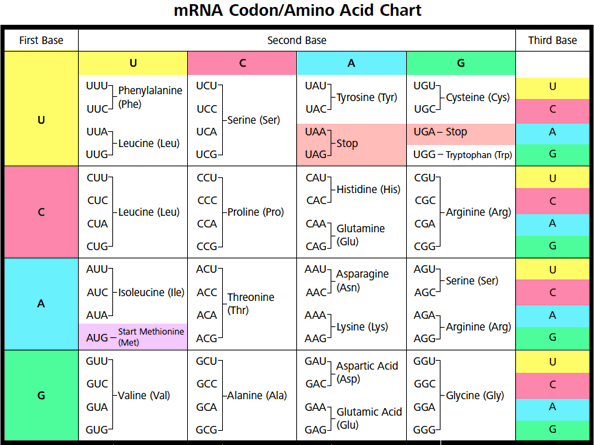
Κάθε 3 νουκλεοτίδια- βάσεις έχουν τη γενετική πληροφορία για ένα αμινοξύ.
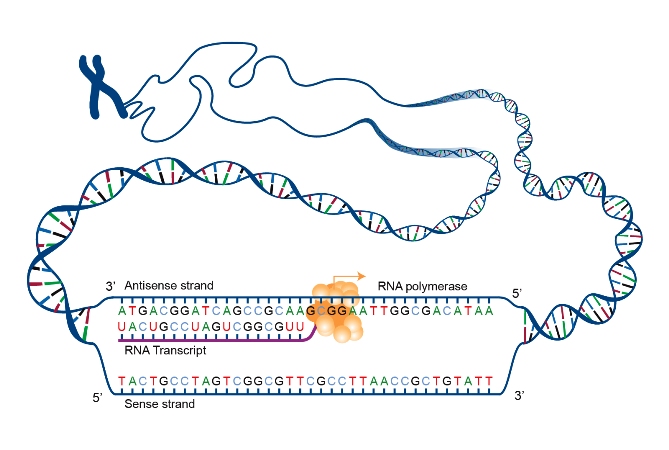
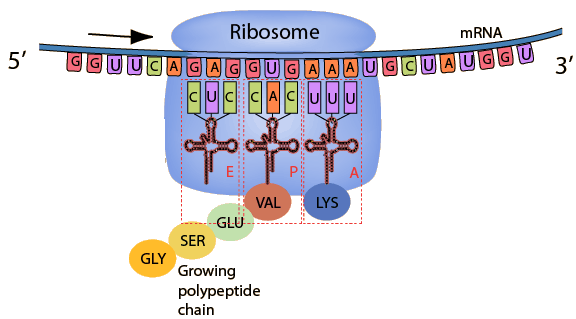
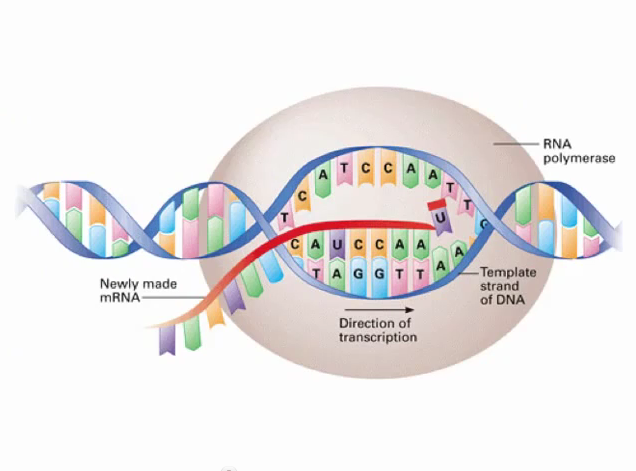
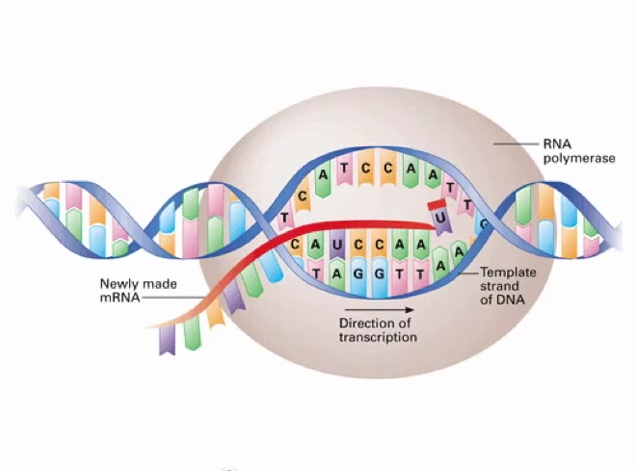
Το αγγελιοφόρο (messenger) m- RNA μεταφέρει τη γενετική πληροφορία, σε μονή έλικα, αφού την αντιγράψει από το DNA του πυρήνα του κυττάρου, στα ριβοσώματα ώστε να παραχθούν τα αμινοξέα και στη συνέχεια οι πρωτεΐνες από αυτά.
Το m- RNA έχει 3 βάσεις ίδιες (Adenine- Α, Cytosine-C, Guanine-G) με το DNA και αντί για την Θυμίνη (Thymine-T) έχει μια ελαφρώς διαφορετική βάση την Uracil- U.
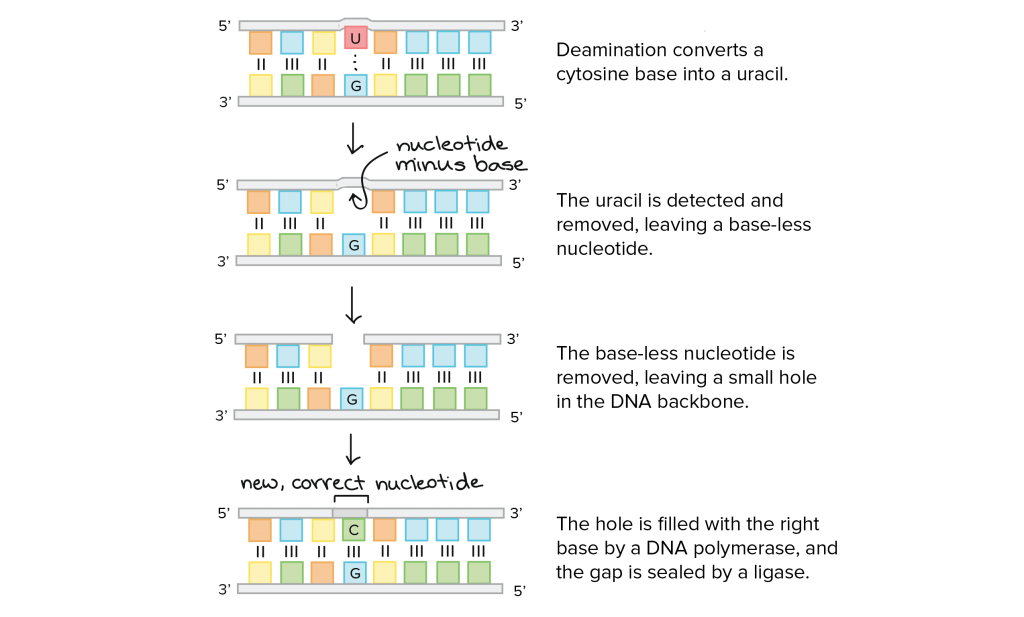
Στο σχεδιάγραμμα φαίνεται η διόρθωση γενετικής πάθησης με μετάλλαξη μόνο μιας βάσης. Αφαιρείται η μεταλλαγμένη βάση U και αντικαθίσταται από την ορθή βάση C.
Τα γονίδια, που μεταφέρουν την κληρονομική πληροφορία για την κατασκευή και λειτουργία μας έχουν από 100δες ως πάνω από 1.000.000 νουκλεοτίδια- βάσεις.
Συνολικά το ανθρώπινο γονιδίωμα (DNA) έχει 20.000 ως 25.000 γονίδια. Το ανθρώπινο γονιδίωμα έχει περισσότερα από 3 δισεκατομμύρια νουκλεοτίδια.
https://www.dnalc.org/view/16933-3D-Animation-of-DNA-to-RNA-to-Protein.html
Έχουμε δύο αντίγραφα από κάθε ένα γονίδιο, ένα από τον πατέρα μας και ένα από τη μητέρα μας. Λιγότερο από το 1% των γονιδίων μας διαφέρουν ελαφρά από άνθρωπο σε άνθρωπο.
TO ΦΑΡΜΑΚΕΥΤΙΚΟ ΟΛΙΓΟΝΟΥΚΛΕΟΤΙΔΙΟ ASO
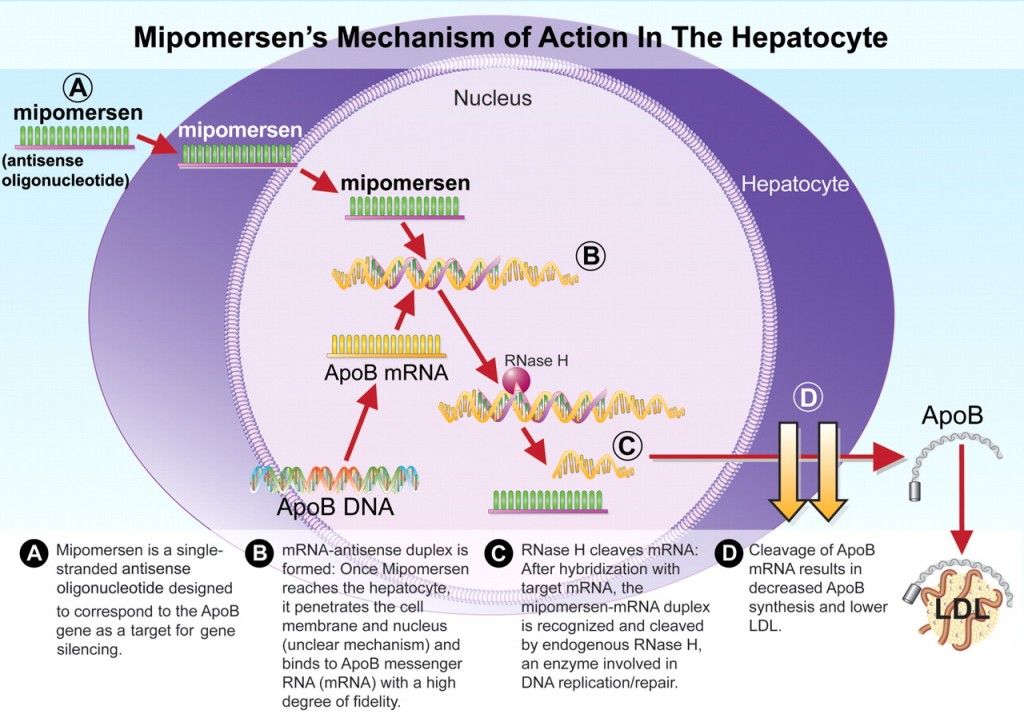
Όταν το φαρμακευτικό ολιγονουκλεοτίδιο ενωθεί σε κάποιο σημείο του m- RNA, μέσω των συμπληρωματικών βάσεων (η Α ενώνεται με την Τ και την U / η C ενώνεται με την G), τότε καταστρέφεται το m- RNA από την Ριβονουκλεάση Η1 οπότε σταματά η παραγωγή της αντίστοιχης πρωτεΐνης από τα ριβοσώματα.
ΜΕΡΙΚΑ ΠΑΡΑΔΕΙΓΜΑΤΑ ΧΡΗΣΙΜΟΠΟΙΗΣΗΣ ΤΩΝ ASO ΣΤΙΣ ΔΥΣΛΙΠΙΔΑΙΜΙΕΣ
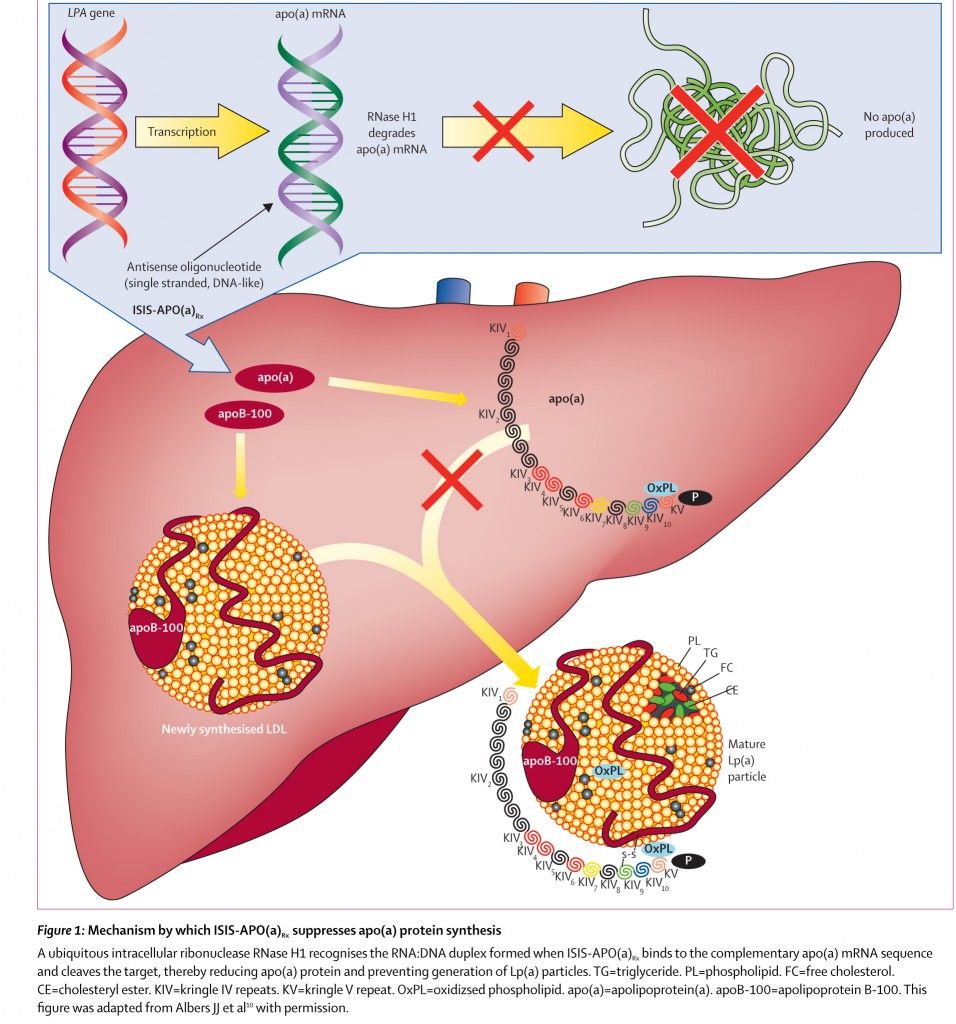
Η θεραπεία με χορήγηση ολιγονουκλεοτιδίου (anti-sense oligonucleotide- ASO), έχει δοκιμαστεί για τη μείωση της αυξημένης Λιποπρωτεΐνης a (Lp- a), μέσω της μείωσης της παραγωγής της Αποπρωτεΐνης a (που ενώνεται με ένα σωματίδιο LDL), με το φάρμακο- ASO, ISIS Apo(a)Rx.
Επίσης έχει δοκιμαστεί ένα φάρμακο- ASO, για τη μείωση της παραγωγής της Απολιποπρωτεΐνης Β 100 (apoB 100), το Μipomersen (Kynamro) ώστε να μειωθούν όλα τα αθηρογόνα σωματίδια που έχουν την apoB 100. Αυτό χορηγείται για τη θεραπεία της ομόζυγης οικογενούς υπερχοληστεριναιμίας (homozygous familial hypercholesterolemia- HoFH).
Επιπλέον έχει δοκιμαστεί το φάρμακο ASO, ISIS 304801 για ανθρώπους με Τριγλυκερίδια πάνω από 350 mg/dL. Αυτό μειώνει την απολιποπρωτείνη C3, που σχετίζεται και με τον μεταβολισμό των πλούσιων σε Τριγλυκερίδια Λιποπρωτεινών.
http://www.nejm.org/doi/full/10.1056/NEJMoa1400283#t=articleBackground
Η ΜΕΙΩΣΗ ΤΗΣ ΠΡΩΤΕΙΝΗΣ ANGPTL 3
Πρόσφατα, το Νοέμβριο 2016, ανακοινώθηκε σε συνέδριο της Αμερικανικής Καρδιολογικής Εταιρίας, η δοκιμή ενός άλλου φαρμάκου- ASO, του IONIS- ANGPTL3- LRx που δρα μειώνοντας την παραγωγή μιας πρωτεΐνης, της ANGPTL 3, ώστε να μειωθούν οι Λιποπρωτεΐνες στο αίμα (οπότε μειώνονται τόσο τα Τριγλυκερίδια, όσο και η LDL χοληστερίνη).
Αυτό δοκιμάστηκε σε εθελοντές με αυξημένα Τριγλυκερίδια και “αδρανοποίησε” το υπεύθυνο γονίδιο που δίνει εντολή για την παραγωγή της πρωτεΐνης ANGPTL 3 στο ήπαρ (selective antisense inhibition of ANGPTL3 expression).
Η αδρανοποίηση γίνεται δυνατή με τη χορήγηση, σαν φαρμάκου, ενός ολιγονουκλεοτιδίου (anti-sense oligonucleotide- ASO), ώστε να ενωθεί με το m- RNA και να σταματήσει η παραγωγή της πρωτεΐνης ANGPTL3, από τα ριβοσώματα των κυττάρων του ήπατος.
Με παρόμοιο τρόπο δρα και το ARO-ANG3 που είναι small interfering RNA (siRNA). Επίσης δοκιμάζεται το μονοκλωνικό αντίσωμα Εvinacumab για εξουδετέρωση της πρωτεΐνης ANGPTL 3.
Η ΔΡΑΣΗ ΤΗΣ ANGPTL3
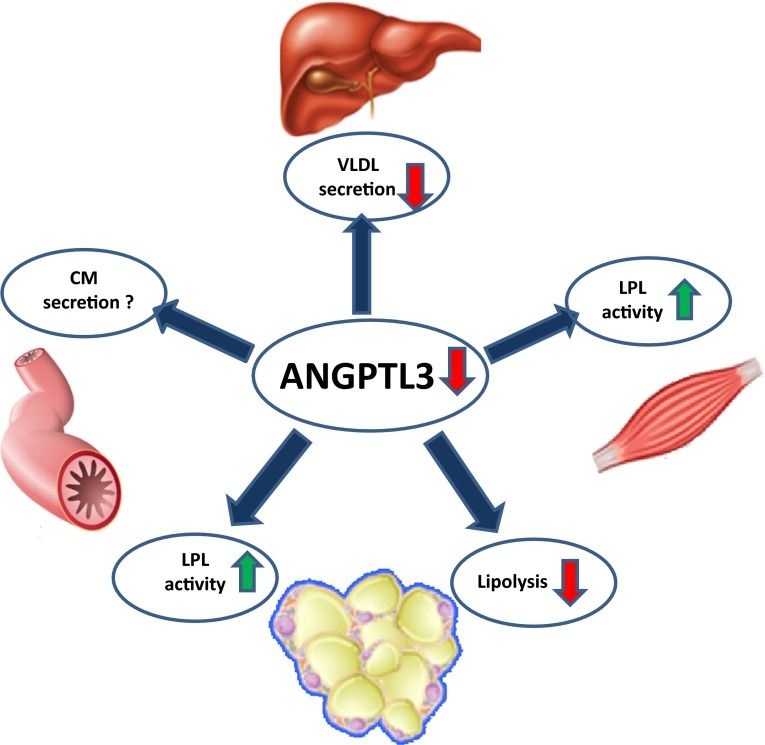
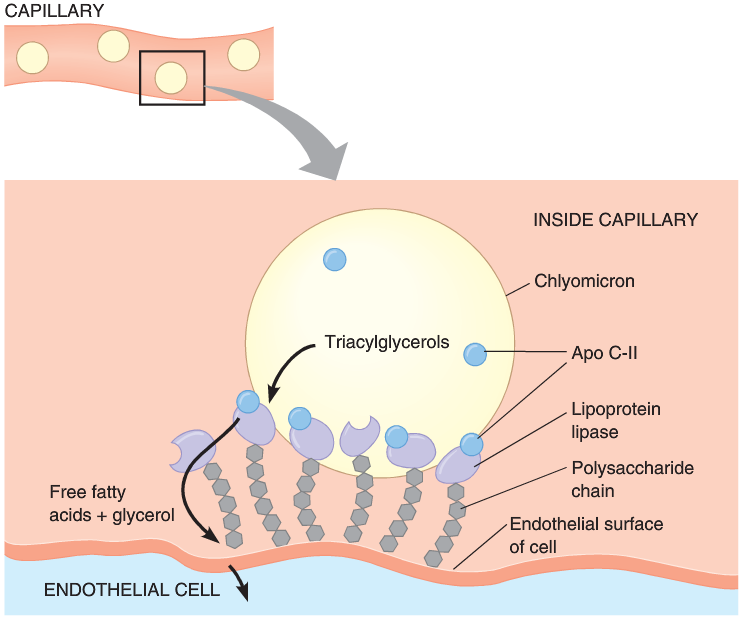
Ορισμένες πρωτεΐνες που μοιάζουν με την αγγειοποιητίνη (Angiopoietin-like protein 3,4,8 (ANGPTL 3,4,8) ρυθμίζουν τα λιπίδια του αίματος μέσω της λιποπρωτεϊνικής λιπάσης (LPL) και της ενδοθηλιακής λιπάσης (EL).
Η λιποπρωτεϊνική λιπάση (LPL) αφαιρεί τα τριγλυκερίδια (και τελικά τα λιπαρά οξέα) κυρίως από τα Χυλομικρά (και τα προσφέρει στον λιπώδη ιστό) και από τις πολύ χαμηλής πυκνότητας λιποπρωτεΐνες –VLDL (και τα προσφέρει στη καρδιά και τους μυς).
Όταν η ANGPTL 3 λείπει, όπως για παράδειγμα σε μετάλλαξη του γονιδίου που δίνει εντολές για την παραγωγή της, έχουμε την οικογενή συνδυασμένη ΥΠΟ-βήτα-λιποπρωτεϊναιμία (familial combined hypobetalipoproteinemia- FHBL 2) όπου είναι πολύ χαμηλή η τιμή όλων των λιποπρωτεϊνών.
Υπ’ όψιν ότι δεν παρατηρούνται προβλήματα στον οργανισμό από την έλλειψη της ANGPTL 3.
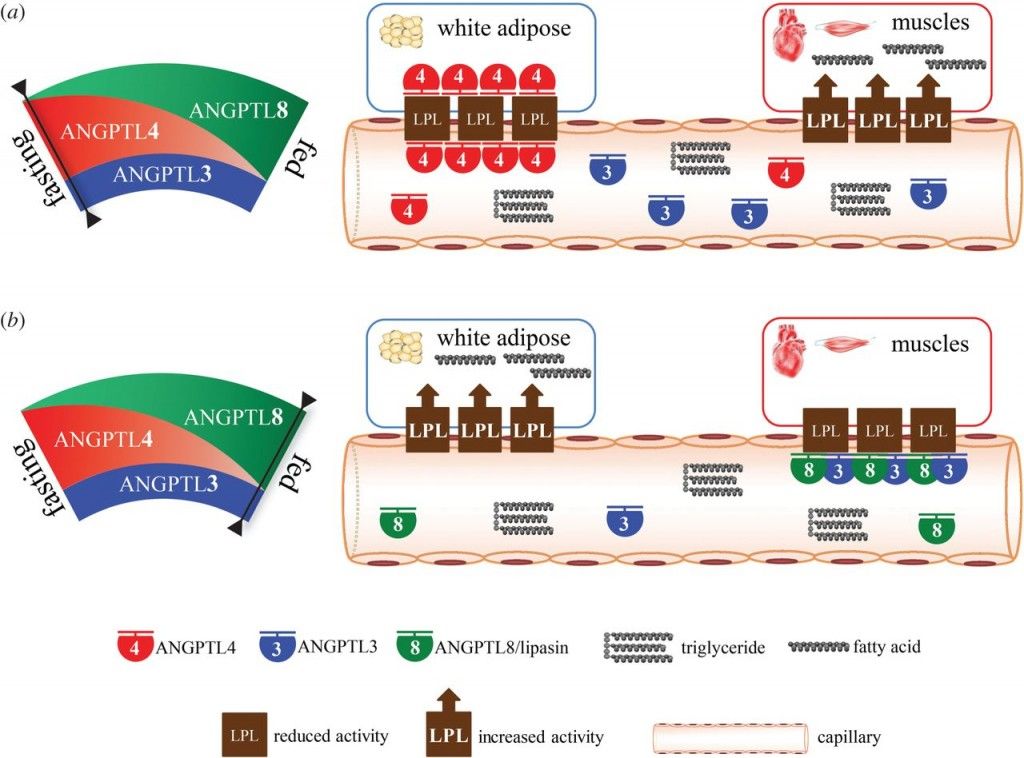
Μετά από φαγητό ενεργοποιείται η ANGPTL3 (παράγεται στο ήπαρ), που εμποδίζει τη δράση της LPL στον καρδιακό και τους σκελετικούς μυς (και μειώνεται η δράση της ANGPTL4) οπότε υπάρχουν τριγλυκερίδια από τα Χυλομικρά (και τελικά λιπαρά οξέα) που προσφέρονται στον λευκό λιπώδη ιστό για αποθήκευση.
Κατά τη νηστεία συμβαίνει το ανάποδο δηλαδή ενεργοποιείται η ANGPTL4 που εμποδίζει τη δράση της LPL στο λιπώδη ιστό και μειώνεται η δράση της ANGPTL3, οπότε αυξάνεται η δράση της LPL που διασπά τα τριγλυκερίδια των πολύ χαμηλής πυκνότητας λιποπρωτεΐνών –VLDL σε λιπαρά οξέα και τα προσφέρει στη καρδιά και τους μυς για ενέργεια.
Σε έλλειψη της ANGPTL3, αυξάνεται η δραστικότητα των δυο λιπολυτικών ενζύμων, οπότε αυξάνεται η ταχύτητα της μετατροπής της VLDL σε ΙDL και αυτής σε LDL και τελικά η πρόσληψη της τελευταίας από το ήπαρ, οπότε μειώνονται και οι τρεις στο αίμα. Μειώνεται επίσης και η ΗDL που εξαρτάται και από τις ΙDL και LDL.
Η λιποπρωτεΐνη a (Lp- a) δεν προέρχεται από τον προηγούμενο κύκλο, οπότε δεν μειώνεται όπως οι προηγούμενες 4 λιποπρωτεΐνες.
Όμως επειδή μειώνεται ταυτόχρονα και η ΗDL, δεν γνωρίζουμε τα μακροχρόνια αποτελέσματα στα καρδιαγγειακά συμβάματα.
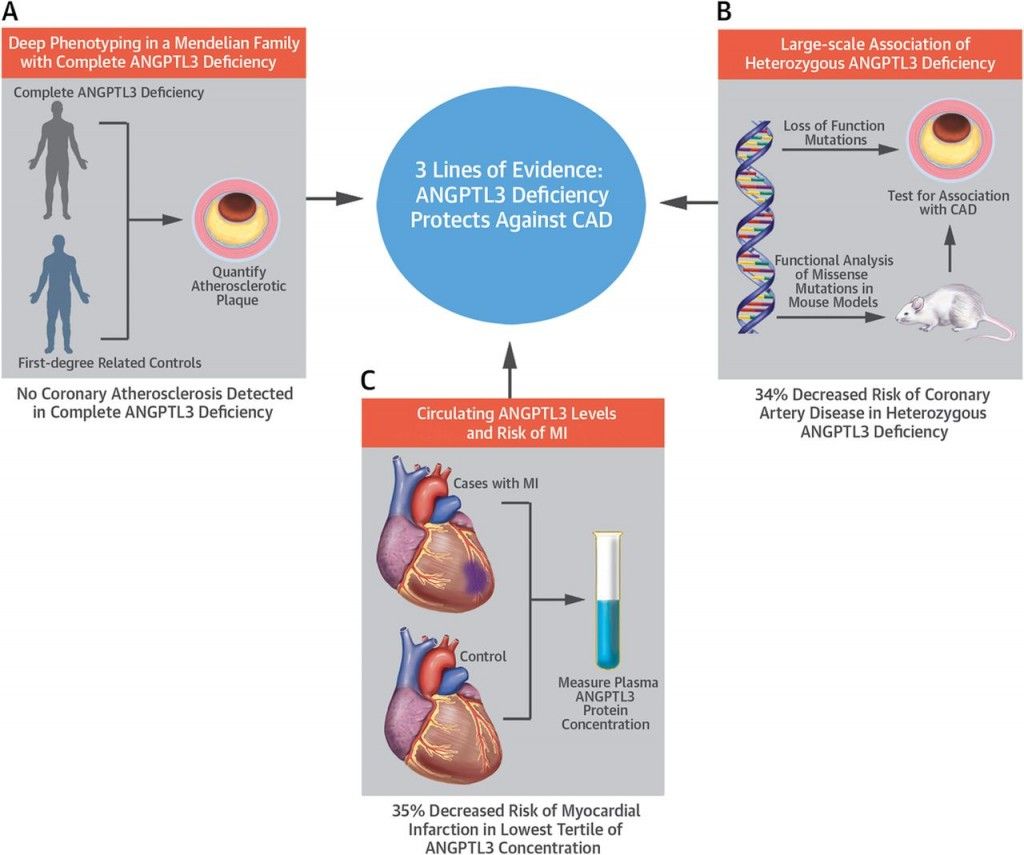
Σε μια πρόσφατη δημοσίευση (Μάρτιος 2017) φάνηκε ότι η εκ γενετής έλλειψη της ANGPTL3 προστατεύει από Στεφανιαία Νόσο.
http://www.onlinejacc.org/content/early/2017/03/28/j.jacc.2017.02.030
Συμπερασματικά: Βλέπουμε ότι άνοιξε ο θαυμαστός καινούργιος κόσμος όπου ο άνθρωπος παρεμβαίνει στη φύση και μέσω των anti-sense ολιγονουκλεοτιδίων (ASO) σταματά τη μετάφραση του γενετικού κώδικα σε πρωτεΐνες.
Μάλλον αυτού του είδους οι παρεμβάσεις με την καταστροφή συγκεκριμένων τμημάτων του m- RNA θα χρησιμοποιούνται στη θεραπεία ορισμένων σπάνιων παθήσεων, συμπεριλαμβανομένων των βαρειών (ομόζυγων) οικογενών Δυσλιπιδαιμιών για την αποτροπή Καρδιαγγειακών παθήσεων.
http://rsob.royalsocietypublishing.org/content/6/4/150272